已知:2SO2 (g) + O2 ═ 2SO3 (g) △H = ﹣196.6kJ•mol﹣1 , 2NO (g) + O2 ═ 2 NO2(g) △H = ﹣ 113.0kJ•mol﹣1.则反应 NO2 (g) + SO2 (g) ═ SO3 (g) + NO (g) 的 △H= .
常温下,两种溶液:①0.1 mol/L HAC②0.1 mol/L NaAC。
(1)溶液①的pH7(填“>”、“<”或“=”),溶液中离子的电荷守恒的关系式是。
(2)溶液②呈性(填“酸”、“碱”或“中”)。其原因是(用离子方程式表示)。
(3)两种溶液中c(AC-)的大小为(填序号)。
a. 两种溶液中c(AC-)都等于0.1 mol/L
b. 两种溶液中c(AC-)都小于0.1 mol/L
c. HAC溶液中c(AC-)小于NaAC溶液中c(AC-)
(4)若将①②两溶液按一定的量混合,混合后溶液显中性,则①②两溶液的体积关系是:①②(填“=”或“>”或“<”)
某小组同学在实验室中组装如下图所示装置,a为铁片,b为石墨,请回答: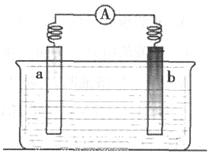
(1)从能量转化的角度看,该装置是将(填能量转化的形式),符合该装置的化学反应类型一定是反应。
(2)若容器内盛有H2SO4溶液,则b极的电极反应式是,b极附近观察到的现象是;导线中电子流动的方向是(用“a→b”或“b→a”表示)。
(3)若容器内盛有NaCl溶液,则a为极(填电极名称);b极的电极反应式是。溶液中的阳离子向(填“a”或“b”)极方向移动。
煤炭可以转化为清洁能源和化工原料。
(1)用煤可以制得水煤气。工业上可用煤和水通过水煤气法制氢气,已知下列热化学方程式:
C(s)+ O2(g)=CO(g)
O2(g)=CO(g)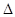 H1=-110.5 kJ/mol
H1=-110.5 kJ/mol
2H2(g)+O2(g)=2H2O(g)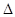 H2=-483.6 kJ/mol
H2=-483.6 kJ/mol
试求水煤气法制氢气的反应的反应热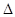 H3。
H3。
C(s)+H2O(g)=CO(g)+H2(g)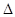 H3=kJ/mol
H3=kJ/mol
(2)已知一氧化碳与水蒸气反应过程的能量变化如下图所示:则此反应为(填“吸热”或“放热”)反应,反应的热化学方程式为。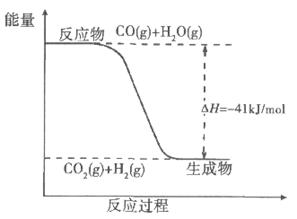
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)  CO2(g)+H2(g),该反应是放热反应
CO2(g)+H2(g),该反应是放热反应
CO和H2O浓度变化如左下图,则0~4min的平均反应速率v(CO)=______mol/(L·min) 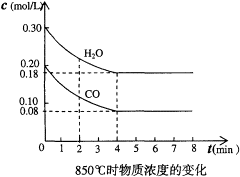

(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。
①表中3min~4min之间反应处于_________状态;C1数值________0.08mol/L(填大于、小于或等于)。
②反应在4min~5min问,平衡向逆方向移动,可能的原因是________(单选),
表中5min—6min之间数值发生变化,可能的原因是________(单选)。
| A.增加水蒸气 | B.降低温度 | C.使用催化剂 | D.增加氢气浓度 |
短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
| |
Q |
R |
|
| T |
|
|
W |
(1)T的原子结构示意图为_______________________。
(2)元素的非金属性为(原子的得电子能力):Q__________R(填“强于”或“弱于”)。(3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____________________________________。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________________________________。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是_______________。