某地有丰富的铝土矿和石灰石资源,拟用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)为原料冶炼铝,工艺流程如下图所示: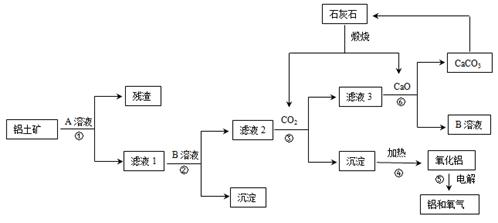
(1)原料A的名称是 ,可循环使用的物质的化学式式为 。
(2)如果省去步骤①,即溶解铝土矿从直接加入B溶液开始,则最终会对氧化铝的生产产生的影响是 。
(3)写步骤③的离子方程式 。
(4)步骤⑤是在铝电解槽中进行,电解槽的两极材料均用石墨,写出阴极的电极反应方程式 。
(5)工业常用阳极氧化法使铝的表面生成致密的氧化膜。如右图是铝阳极氧化实验装置图:a端是电源的 极。铝片表面形成氧化铝的原理是(用电极方程式表示) , (填“能”或“不能”)用较浓NaCl溶液代替20%H2SO4作电解液进行铝的阳极氧化,若不能,请说明理由 。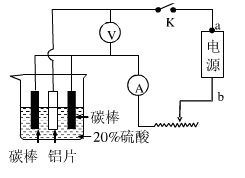
将Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100mL盐酸,充分反应后溶液为中性,放出气(已干燥)2.24L(标准状况),将生成的气体全部通入另一份混合粉末,充分反应后气体的体积变为2.016L(标准状况),问:
(1)2.24L气体的成分为:;
(2)试通过讨论并计算每份混合粉末中Na2O2和NaHCO3的物质的量:
第一种情况:n(Na2O2)=mol和n(NaHCO3)=mol;
第二种情况:n(Na2O2)=mol和n(NaHCO3)=mol.
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子:K+ Na+Cu2+Al3+
阴离子:SO42-HCO3- OH-Cl-
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成。根据上述实验填空:
(1)写出B、D的化学式:B____,D。
(2)C可用作净水剂,用离子方程式表示其净水原理_______。
(3)将含0.01 mol A的溶液与含0.02 mol E的溶液反应后,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是

(4)在m mL b mol·L-1C溶液中,加入等体积a mol·L-1的E溶液。
当a≤3b时,生成沉淀的物质的量是mol;
当3b<a<4b件时,生成沉淀的物质的量是mol。
以下是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色。
(1)若F是由Na+和SO42-组成的溶液,则甲的化学式是 _____________,列举A物质的一种用途______________________________________________________________。
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为________,丁属于单质、酸、碱中的________;在I溶液中加入氢氧化钠溶液,可以观察到的现象是______________________________,
对应的离子方程式和化学方程式依次是______________________,___________________。
(3)写出G→A+C的化学方程式: ___________________________________。
(4)写出E和C反应的方程式并用单线桥法标明电子的转移方向和数目:__________。
(5)若A中混有杂质Al2O3,除去杂质的方法是加入过量的________,该反应的离子方程式为__________。
(6)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4∶1。则反应物中A、E、H2SO4的物质的量之比为________。
已知A、B、C、D、E、F、G为中学化学中常见的化合物,其中A是淡黄色固体,B是无色液体,G为红褐色沉淀。常温下甲、乙、丙为气态非金属单质,丙呈黄绿色;丁、戊为常见金属单质,其中戊是当前用量最大的金属。它们之间的转化关系如下图所示(有的反应部分产物已经略去)。请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A,E,戊。
(2)F转化为C的过程中出现的现象是:。
(3)写出②中反应的离子方程式:。
(4)①~⑥转化中不含有氧化还原反应的是:(填序号)。
盐酸、硫酸和硝酸是中学阶段常见的三种强酸。它们的浓度不同可能会影响它们的某些化学性质。在三种酸中:
(1)常温下能用铁制容器盛装的是(填名称,下同)。
(2)检验氯离子时使用的是酸化的硝酸银溶液;高锰酸钾溶液的氧化性与溶液的酸性有关,通常使用 来酸化;能溶解金和铂的是的混合液。
(3)向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,已知该反应的产物只有氯化铜和水。写出其离子方程式 。
(4)在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体换算成标准状况下的体积可能是。
①6.72L②20.16L③30.24L ④40.32L