元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素。请用所给元素回答下列问题。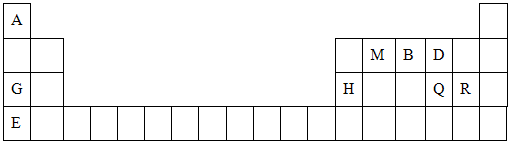
(1)Q元素在元素周期表中的位置 ,E元素原子结构示意图为_____
(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)_________________________________。
(3)M、D两元素形成的化合物中含有的化学键类型是 ,其MD2分子的结构式: 。
(4)用表中所给元素组成反应物,用化学方程式说明元素Q和R非金属性的强弱:
;元素G、H的金属性强弱:
阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入2滴酚酞。 |
| B.用待测定的溶液润洗酸式滴定管 |
| C.用蒸馏水洗干净滴定管 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至 刻度“0”或“0”刻度以下 |
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写)E→ C → D→ →→→F ;
②在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”
或“恰好合适”)。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是:。
(4)如有1mol/L和0.1mol/L的NaOH溶液,应用 的NaOH溶液。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入(选填“甲”或“乙”)中。(右图)
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值(选填“偏大”“偏小”或“无影响”)
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)。
现有几种物质的熔点数据如下表:
| A组 |
B组 |
C组 |
D组 |
| 金刚石:3550 ℃ |
Li:181 ℃ |
HF:-83 ℃ |
NaCl:801 ℃ |
| 硅晶体:1410 ℃ |
Na:98 ℃ |
HCl:-115 ℃ |
KCl:776 ℃ |
| 硼晶体:2300 ℃ |
K:64 ℃ |
HBr:-89 ℃ |
RbCl:718 ℃ |
| 二氧化硅1723 ℃ |
Rb:39 ℃ |
Hi:-51 ℃ |
CsCl:645 ℃ |
据此完成下列问题:
(1)A组属于__________晶体,其熔化时克服的粒子间的作用力是__________。
(2)B组晶体共同的物理性质是__________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于____________________。
(4)D组晶体可能具有的性质是__________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)XY晶体的单元结构如下图所示,晶体中距离最近的X+与Y-的核间距离为a cm,已知阿伏加德罗常数为Na mol-1,其密度为ρ g·cm-3,则XY的摩尔质量可表示为 __________
g·mol-1。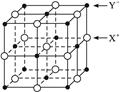
白磷分子中P—P键易断开,若一个白磷分子中每个P—P键均断开插入一个氧原子,则一共可结合__________个氧原子,这样得到磷的一种氧化物,其分子式为__________。由C、H、N三种元素组成的某化合物,其分子内含4个氮原子,且4个氮原子排成内空的正四面体(同白磷),每两个氮原子间都有一个碳原子,且分子内无C—C和C===C,则化合物的分子式__________。
有下列八种晶体:
| A.水晶 | B.冰醋酸 | C.氧化镁 | D.白磷 E.晶体氩 F.氯化铵 G.过氧化钾 H.金刚石 |
(1)属于原子晶体的化合物是__________,直接由原子构成的晶体是__________,直接由原子构成的分子晶体是__________。
(2)由极性分子构成的晶体是__________,含有共价键的离子晶体是__________,属于分子晶体的单质是__________。
(3)受热熔化后化学键不发生变化的是__________,需克服共价键的是__________。
制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷目的。人们曾采用过乙醚、CH3Cl等作制冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的制冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期,__________>__________>H2O>HF;第三周期,SiH4>PH3>__________>__________。
(2)化合物的毒性:PH3>NH3;H2S__________H2O;CS2__________CO2;CCl4>CF4(选填“>”或“<”)。于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8 ℃,CF4的沸点为-128 ℃。新制冷剂的沸点范围介于其间。经过较长时间的反复试验,一种新的制冷剂氟利昂CCl2F2终于诞生了,其他类似的还可以是__________。
(4)然而,这种制冷剂造成了当今的某一环境问题是__________。但求助于周期表中元素及其化合物的__________变化趋势来开发制冷剂的科学思维方法是值得借鉴的。
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
A.①②③ B.②④⑤ C.②③④