(18分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _
(2)若两池中均为饱和NaCl溶液:
①乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”),写出乙池中该电极反应的离子方程式_______________________________________。
②甲池中碳极上电极反应式是_____________,检验该负极反应产物的方法是_____________________________用离子方程式表示_______________________________
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混匀后的pH=________。
甲烷分子呈结构,其结构式为 ;乙烯分子中2个碳原子和4个氢原子在同一内,其结构简式为 ;乙炔的分子式为,其分子呈结构,乙炔的电子式是。
在原电池中,较活泼的金属发生反应,是极;活动性较差的金属极上发生反应,是极。潮湿空气中钢铁表面容易发生腐蚀,发生腐蚀时,铁是极,电极反应式为;杂质碳是极,电极反应式为。
在水的电离平衡中,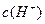 和
和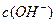 的关系如下图所示:
的关系如下图所示: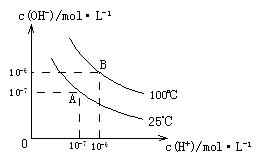
(1)A点水的离子积为1×10-14,B点水的离子积为。造成水的离子积变化的原因是。
(2)25℃时,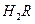 在水溶液中的电离方程式为:
在水溶液中的电离方程式为: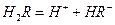 ,
,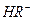

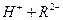 。
。
① 0.1 mol/L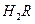 溶液的pH1(填“>”、“<”或“=”)。
溶液的pH1(填“>”、“<”或“=”)。
②在0.1 mol/L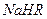 溶液中,各离子浓度由大到小的顺序是:
溶液中,各离子浓度由大到小的顺序是:
。
(3)100℃时,0.01 mol/L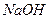 溶液的pH = 。
溶液的pH = 。
(4)100℃时,将pH =8的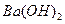 溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则
溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则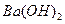 溶液与盐酸的体积比为。
溶液与盐酸的体积比为。
在一定体积的密闭容器中,进行如下化学反应:

 ,其化学平衡常数K和温度T的关系如下表:
,其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为(填“吸热”或“放热”)反应。
(3)能判断该反应已达到化学平衡状态的依据是()
| A.容器中压强不变 | B.混合气体中 不变 不变 |
C. |
D. |
(4)某温度下,平衡浓度符合下式: ,试判断此时的温度为℃。
,试判断此时的温度为℃。
25℃时,将0.01 mol 和0.002 mol
和0.002 mol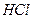 溶于水,形成1L混合溶液:
溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①;
②;
③。
(2)溶液中共有七种不同的粒子(指分子和离子)。在这些粒子中,浓度为0.01 mol/L的是,浓度为0.002 mol/L的是;和两种粒子物质的量之和等于0.01 mol。