甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。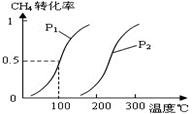
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)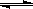 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
①已知100℃时达到平衡所需的时间为5min,
②则用H2表示的平均反应速率为_ 。图中的P1_ _P2(填“<”、“>”或“=”),
100℃时平衡常数为_  _。
_。
③在其它条件不变时降低温度,逆反应速率将_ _(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)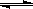 CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④ 该反应的△H_ _0,△S_ _0(填“<”、“>”或“=”)。
该反应的△H_ _0,△S_ _0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是_ _。
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中。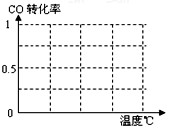
| l 实验编号 |
l T(℃) |
l n (CO)/n(H2) |
l P(MP) |
| l ⅰ |
l 150 |
l 1/3 |
l 0.1 |
| l ⅱ |
l __ |
l __ |
l5 |
| l ⅲ |
l 350 |
l __ |
l 5 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
在一密闭容器中反应2SO2+O2 2SO3经5秒后,SO3的浓度增加了0.4mol·L-1,则在这段时间内用O2表示的反应速率为mol·L-1·s-1。
2SO3经5秒后,SO3的浓度增加了0.4mol·L-1,则在这段时间内用O2表示的反应速率为mol·L-1·s-1。
已知A、B、C、D、E、F是短周期中的6种非金属元素,它们的原子序数依次增大。A元素是周期表中半径最小的元素, B原子的最外层上有4个电子;C与D在周期表中处于相邻的位置,D的阴离子和E的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体Y;F的L层电子数等于K、M两个电子层上电子数之和
(1)请写出元素符号:
ABCDE F
(2)画出F的阴离子的结构示意图
(3)A单质和C单质在一定条件下反应生成化合物X,该反应的化学方程式为
向X的水溶液中滴入酚酞溶液,会观察到
(4)写出E在D的单质中点燃,生成固体Y化学方程式
(5)将12gB单质在足量的D单质中燃烧,所得气体通入1L 1mol/L NaOH溶液中,完全吸收后,溶液中大量存在的离子是。(相对原子质量:C—12)
请根据反应Fe+CuSO4==Cu+FeSO4设计一个原电池,画出装置图
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
|||||
| 3 |
B |
C |
J |
F |
H |
I |
(1)表中元素,化学性质最不活泼的是,只有负价而无正价的元素是, 可用于制半导体材料的元素是_______
(2)C元素在元素周期表中的位置是周期族。
(3)最高价氧化物的水化物碱性最强的是,酸性最强的是,呈两性的是;
(4)A分别与E、G、H形成的化合物中,最稳定的;
(5)在B、C、E、F中,原子半径最大的是.
(6)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式。
(7)B、H两种元素形成的化合物所含的化学键类型为
(8)写出C的最高价氧化物与H的氢化物之间反应的离子方程式_________________。
加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。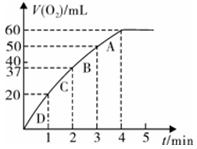
①写出H2O2在二氧化锰作用下发生反应的化学方程式。
②实验时放出气体的总体积是mL。
③放出1/3气体所需时间为min。
④反应放出3/4气体所需时间约为min。
⑤A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
⑥解释反应速率变化的原因。
⑦计算H2O2的初始物质的量浓度_____________。(请保留两位有效数字)