姜黄素(分子式为C21H20O6)具有搞突变和预防肿瘤的作用,其合成路线如下: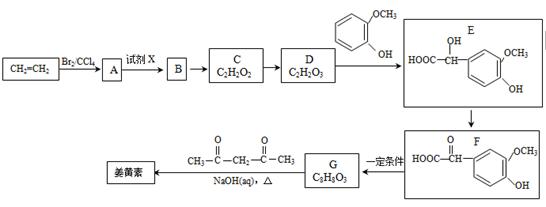
已知
①
②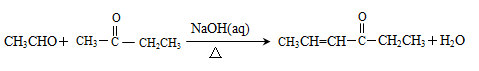
请回答下列问题:
(1)D中含有的官能团名称 。
(2)试剂X为 。
(3)姜黄素的结构为 。
(4)反应D—E的化学方程式为 ,其反应类型是 。
(5)下列有关G(C8H8O3)的叙述不正确的是 (填正确答案编号)。
a.能与NaHCO3溶液反应
b.能与浓溴水反应
c.能与FeCl3溶液发生显色反应
d.1molG最多能与3molH2发生加成反应
(6)G(C8H8O3)的同分异构体中,符合下列条件的共有 种。
①苯环上的一取代物只有2种;
②1mol该物质与烧碱溶液反应,最多消耗3molNaOH.
其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为 。
铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,化学式为Cu2(OH)2CO3,“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿……→铜”的转化。
(1)从三种不同分类标准回答,“铜绿”属于哪类物质?
________、________、________。
(2)请写出铜绿与盐酸反应的化学方程式_________________________________。
(3)写出B的化学式________。
(4)上述转化过程中属于化合反应的是________,属于复分解反应的是________。
(5)胶体铜在电子行业、塑料和陶瓷电镀等方面应用广泛。下列关于溶液和胶体的叙述,正确的是________。
| A.一束光线分别通过溶液和胶体时,后者能看到一条光亮的“通路”,前者则没有 |
| B.溶液是电中性的,胶体是带电的 |
| C.溶液中溶质分子可以通过滤纸,胶体中分散质粒子则不能通过滤纸 |
| D.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 |
下面是有关物质的转化关系图,其中A为单质,E在常温下为液体,D是一种温室气体,C的相对分子质量为78。请回答相关问题。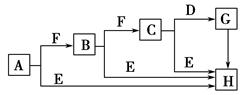
(1)下列对C的结构、性质推断中不正确的是 ( )。
| A.久置于空气中会变成白色 |
| B.具有强氧化性 |
| C.晶体中存在离子键与非极性键 |
| D.是一种碱性氧化物 |
(2)A的原子结构示意图为______________,H的电子式为______________,E的结构式为____________________。
(3)C和E反应生成H的离子方程式为__________________,反应中氧化剂与还原剂的物质的量之比为______。
硅及其化合物对人类现代文明的发展具有特殊贡献。请回答下列有关问题:
(1)硅原子的结构示意图:________。
(2)下列物品或设备所用的材料属于硅酸盐的是________。
①长江三峡水泥大坝 ②石英光导纤维 ③陶瓷坩埚
④普通玻璃 ⑤硅太阳能电池
| A.①②⑤ | B.③④⑤ | C.②③④ | D.①③④ |
(3)常温下,SiCl4为液态,沸点为57.6 ℃,在空气中冒白雾。制备高纯度硅的中间产物SiCl4中溶有液态杂质,若要得到高纯度SiCl4,应采用的方法是________;用化学方程式及必要文字解释SiCl4在空气中冒白雾的原因:________________________________
印刷电路的废腐蚀液中含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl2 3.0 mol·L-1、FeCl3 1.0 mol·L-1、HCl 3.0 mol·L-1。
取废腐蚀液200 mL按如下流程在实验室进行实验: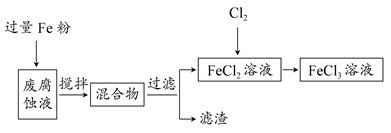
回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为________。
②检验废腐蚀液中含有Fe3+的实验操作是________;在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、________。
③由滤渣得到纯铜,除杂所需试剂是________。
(2)某化学兴趣小组利用下图所示装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
①实验开始前,某同学对实验装置进行了气密性检查,方法是________。
②浓盐酸与二氧化锰加热反应的化学方程式为________;烧杯中NaOH溶液的作用是________。
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于________g,需通入Cl2的物质的量应不少于________ mol。
在下图所示转化关系中,A是一种固体单质,E是一种白色沉淀,F为密度最小的无色气体。且各种物质所含元素除H、O外,其余均为第三周期元素。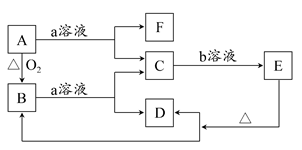
请按要求回答下列问题:
(1)若实现C→E转化所需的b溶液是“过量的盐酸”,则B的化学式为________。
(2)若实现C→E转化所需的b溶液不能使用“过量的盐酸”,只能使用“少量的盐酸”,则C的溶液显________(填“酸”“碱”或“中”)性;A和a溶液反应,若产生标准状态下3.36 L的F气体,转移的电子数目为________。
(3)若实现C→E转化所需的b溶液是“过量的NaOH溶液”,则E的化学式为________;反应B+a→C+D的离子方程式为___________________________。