苯乙烯是现代石油化工产品中最重要的单体之一。在工业上,苯乙烯可由乙苯和CO2
催化脱氢制得。总反应原理如下: △H
△H
回答下列问题:
(1)乙苯在CO2气氛中的反应可分两步进行: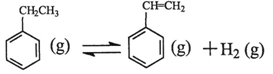 △H1=+117.6kJ·mol-1
△H1=+117.6kJ·mol-1
H2 (g)+CO2 (g) CO (g)+H2O (g) △H2=+41.2kJ·mol-1
CO (g)+H2O (g) △H2=+41.2kJ·mol-1
由乙苯制取苯乙烯反应的 。
。
(2)在温度为T1时,该反应的平衡常数K=0.5mol/L。在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得混合物中各组分的物质的量均为1.0mol。
①该时刻化学反应 (填“是”或“不是”)处于平衡状态;
②下列叙述能说明乙苯与CO2在该条件下反应已达到平衡状态的是 (填正确答案编号);
a.正、逆反应速率的比值恒定 b.c(CO2)=c(CO)
c.混合气体的密度不变 d.CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度 (填正确答案编号)
| A.大于0.5mol/L | B.小于0.5mol/L |
| C.等于0.5mol/L | D.不确定 |
(3)在温度为T2时的恒容器中,乙苯、CO2的起始浓度分别为2.0mol/L和3.0mol/L,设反应平衡后总压强为P、起始压强为 ,则反应达到平衡时苯乙烯的浓度为 , (均用含
,则反应达到平衡时苯乙烯的浓度为 , (均用含 、P的表达式表示)。
、P的表达式表示)。
(4)写出由苯乙烯在一定条件下合成聚苯乙烯的化学方程式 。
(6分)如图A、B、C、D、E各代表铁、水、三氧化硫、盐酸和氢氧化钡中的一种物质。在常温下,相连环物质之间能发生反应,不相连环物质之间不能发生反应。且B的相对分子质量小于D。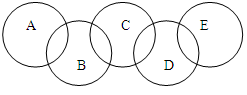
(1)五中物质中属于氧化物的有(填化学式)。
(2)请写出氢氧化钡的电离方程式。
(3)请写出铁与水蒸汽在高温下发生反应的化学方程式
。
(4)请写出下列物质的化学式:B,D(填化学式)。
(4分)选择下列实验方法分离物质,将分离方法的序号填在横线上:
| A.过滤 | B.结晶 | C.分液 | D.蒸馏 E.萃取分液 F.升华 |
(1)分离水和四氯化碳的混合物;
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
(4)从碘水中提取碘单质。
(1)在一定温度下,将2molA和2molB两种气体混合于2L密闭容器中,发生反应:3A(g)+2B(g) x C(g)+2D(g)ΔH <0,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.2mol/L。由此推断:
x C(g)+2D(g)ΔH <0,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.2mol/L。由此推断: ① x值等于;② B的平衡浓度为。
① x值等于;② B的平衡浓度为。 ③ A的转化率为。
③ A的转化率为。
④由于条件改变而引起反应速率和化学平衡的变化情况,a---b过程中改变的条件可能是;b----c过程中改变的条件可能是;之后若增大压强时,请把反应速率变化情况画在上图中的c-----d处(标明V正和V逆)该条件下反应建立新平衡后体系中混合气体的平均相对分子质量(填“增大”或“减小”或“不变”)。
 2SO2(g) + O2(g) = 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= —99kJ·mol-1.请回答下列问题:
2SO2(g) + O2(g) = 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= —99kJ·mol-1.请回答下列问题:
 (1)图中A、C分别表示、,E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
(1)图中A、C分别表示、,E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是; (2)图中△H=KJ·mol-1;
(2)图中△H=KJ·mol-1; (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式
、; (4)已知单质硫的燃烧热为296 KJ·mol-1,写出硫的燃烧热方程式:
(4)已知单质硫的燃烧热为296 KJ·mol-1,写出硫的燃烧热方程式:
计算由S(s)生成2molSO3(g)的△HKJ·mol-1。
在密闭容器中进行的反应C(s)+ H2O(g)  CO(g) + H2(g)
CO(g) + H2(g)  ,改变下列条件:(1)若升高温度,正反应速率,逆反应速率(填增大或减小或不变),平衡移动。
,改变下列条件:(1)若升高温度,正反应速率,逆反应速率(填增大或减小或不变),平衡移动。
(2)若增大CO的浓度,平衡移动,H2O(g)的转化率(填增大或减小或不变)。