为测定一种复合氧化物材料的组成。称取12.52g样品,将其全部溶于过量稀硝酸后,配成100ml溶液。取其一半,加入过量K2SO4溶液,生成白色沉淀,经过滤、洗涤、烘干后得4.66克固体。在余下的50毫升溶液中加入少许KSCN溶液, 显红色;如果加入过量NaOH溶液,则生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20克固体。计算确定该材料的化学式为 。
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_____________, K值大小与温度的关系是:温度升高,K值______________。(填一定增大、一定减小、或可能增大也可能减小);
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0。
CO2(g) +H2 (g) △H<0。
CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。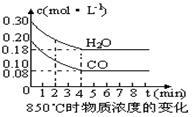
(3)该反应的化学平衡常数表达式为K= _,850℃时当反应进行到4min时即达到平衡状态,这时化学平衡常数的数值为 。
依据事实,写出下列反应的热化学方程式.
(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O. 放出571.6kJ的热量,表示H2燃烧的热化学方程式为__________
(2)在25℃、101kPa下,1g甲醇(CH3OH)液体燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为______ _
(3)已知:已知:C(s)+O2(g)=CO2(g)△H=﹣437.3kJ•mol一1
H2(g)+ O2(g)═H2O(g)△H=﹣285.8kJ•mol一1
O2(g)═H2O(g)△H=﹣285.8kJ•mol一1
CO(g)+ O2(g)═CO2(g)△H=﹣283.0kJ•mol一1
O2(g)═CO2(g)△H=﹣283.0kJ•mol一1
则煤的气化主要反应(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式是_____ ____
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。
工业上用软锰矿(主要成分是二氧化锰)制取高锰酸钾和软磁铁氧体材料MnxO4,其流程如下(部分条件和产物省略):
请回答下列问题: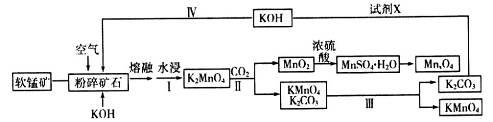
(1)K2MnO4中锰元素的化合价是___________。
(2)写出粉碎矿石和氢氧化钾熔融物中通入空气时,发生主要反应的化学方程式___________________。
(3)分析下表数据。工业上采用III得到较纯净的高锰酸钾,III中包含的操作名称是________________。
(4)上述工业流程中试剂X的最佳物质是(填化学式)_________________________;设计步骤IV的目的是________________________。
(5)通过煅烧MnSO4·H2O可制得软磁铁氧体材料MnxO4。如图是煅烧MnSO4·H2O时温度与剩余固体质量变化的曲线。该曲线中A段所表示物质的化学式是_____________;MnxO4中x=_________________________。
许多含氯物质与生活密切相关,如HClO、ClO2、NaClO2等都是重要的杀菌消毒剂和漂白剂。其中制备NaClO2的工业流程下图所示: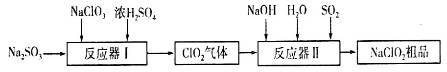
请回答下列问题:
(1)反应器I中反应的氧化剂是___________________。
(2)反应器Ⅱ中发生反应的离子方程式为_________________________________。
(3)通入反应器Ⅱ中的SO2能用H2O2代替,请简要说明理由____________________。
(4)为了测定NaClO2粗品的纯度,取上述粗产品10.0 g溶于水配成1 L溶液,取出10 mL,溶液于锥形瓶中,再加入足量酸化的KI溶液。充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1Na2S2O3标准液漓定,达到滴定达终点时用去标准液20.00 mL,试计算NaClO2粗品的纯度___________。(提示:2Na2S2O3+I2====Na2S4O6+2NaI)