(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出热量649.5 中kJ,则表示乙硼烷燃烧热的热化学方程为 .
又已知:H2O(l)═H2O(g);△H=+44.0kJ/mol.则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量为 .
(2)恒温、恒压(1.01×105Pa)下,将2.0molSO2与amolO2的混合气体通入一个容积可变的密闭容器中,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g);△H<0,T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,则a= .
【化学-选修3,物质结构与性质】X、Y、Z、W都是元素周期表中的前四周期元素,它们的核电荷数依次增大。X原子的最外层p轨道的电子为半充满结构,Y是地壳中含量最多的元素。Z元素形成的一种化合物常用作净水剂。W元素是第四周期元素中未成对电子数最多的元素,WCl3能与X、Y的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1mol配合物与足量的AgNO3溶液反应能生成3molAgCl。请回答下列问题:
(1)XH3可作低温溶剂,它易液化的原因是,Y所在周期中第一电离能最大的主族元素是。
(2)XY3-离子的立体构型是,其中心原子采取杂化。
(3)W3+的核外电子排布式是,WCl3形成的六配位的配合物化学式为。
(4)某种Z—Fe合金的晶胞如图所示,该合金的化学式为。若晶胞的边长为a nm,则合金的密度为g·cm-3。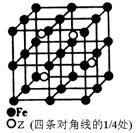
【化学——选修2:化学与技术】下图是某企业设计的硫酸—磷肥—水泥联产、海水—淡水多用、盐—热—电联产的三大生态产业链流程图。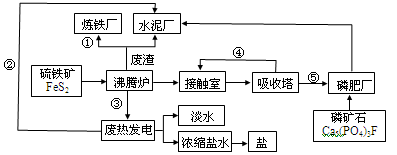
根据上述产业流程回答下列问题:
(1)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:
①、②、③、④、⑤。
(2)接触室发生反应的化学方程式:。磷肥厂的主要产品是普钙(磷酸二氢钙和硫酸钙),写出由磷矿石和硫酸反应制普钙的化学方程式。
(3)用1吨硫铁矿(FeS2的质量分数为36%)接触法制硫酸,制硫酸的产率为65%,则最后能生产出质量分数为98%的硫酸吨。
(4)吸收塔中用吸收SO3,理由是。
(5)根据现代化工厂设计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想。
,(写出两点即可)。
以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,用化学沉降法处理含砷废水,相关数据如下表。
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=mol·L-1。
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为。
(14分)氨的合成是最重要的化工生产之一。
Ⅰ.工业上合成氨用的H2有多种制取的方法:
① 用焦炭跟水反应:C(s)+H2O(g) CO(g) + H2(g);
CO(g) + H2(g);
② 用天然气跟水蒸气反应:CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
已知有关反应的能量变化如下图,且方法②的反应为吸热反应,则方法②中反应的ΔH =___________kJ/moL。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)  2NH3(g)
2NH3(g)
按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
3 |
c2 |
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t5min,表中c1c2。(填“>”、“<” 或“=”)
(3)用氨合成尿素的反应为2NH3(g)+CO2(g)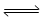 CO(NH2)2(s)+H2O(g)。工业生产时,原料气带有水蒸气。图1表示CO2的转化率与氨碳比
CO(NH2)2(s)+H2O(g)。工业生产时,原料气带有水蒸气。图1表示CO2的转化率与氨碳比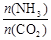 、水碳比
、水碳比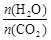 的变化关系。
的变化关系。
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是。
②测得B点氨的转化率为30%,则x1=。
Ⅲ.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。
电池正极的电极反应式是,A是。
[化学——选修3:物质结构与性质] 周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。请填写下列空白。
(1)e元素基态原子的核外电子排布式为____________。
(2)b、c、d三种元素的第一电离能数值由小到大的顺序为____________(填元素符号),其原因是__________________。
(3)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键,又含有非极性共价键的化合物是(填化学式,写出两种)。
(4)已知c、e能形成晶胞如图甲和图乙所示的两种化合物,化合物的化学式为分别为:甲________,乙;甲高温易转化为乙的原因是__________________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图丙所示)。该化合物中,阴离子为,该化合物加热时首先失去的组分是,判断理由是。