已知A、B、C、D和E都是元素 周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周
周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周 期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成
期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成 离子化合物其晶胞结构如图。
离子化合物其晶胞结构如图。
 请回答:
请回答: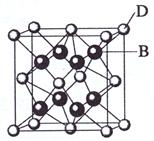
 (1)
(1) 画出A的原子结构示意图 ;
画出A的原子结构示意图 ;
(2) E的+2价离子的电子排布式为
E的+2价离子的电子排布式为  ;
;
(3) 写出C的单质与水反应的离子方程式 ;
写出C的单质与水反应的离子方程式 ;
(4)如图所示,D跟B形成的离子化合物的化学式为 ;鉴 别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相
别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相 对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。
对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。
用锌棒、石墨和CuCl2溶液组成的原电池,锌棒为___极,电极反应式为_________,石墨为___极,电极反应式为______,原电池反应的离子方程式为___________。
已知乙烯能发生以下转化关系: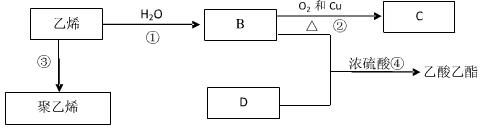
|
试回答下列问题:
(1)写出②、④反应的化学方程式及 反应类型:
反应类型:
②: 反应类型:
④: 反应类型:  (2)乙烯和其它物质发生加成反应,不能得到的是 (填标号)。
(2)乙烯和其它物质发生加成反应,不能得到的是 (填标号)。
| A.CH3CH3 | B.CH3CHCl2 | C.CH3CH2OH | D.CH3CH2Br |
几种短周期元素的原子半径及其某些化合价见下表:
| 元素代号 |
A |
B |
D |
E |
G |
H |
J |
L |
| 常见化合价 |
-1 |
-2 |
+4、-4 |
+6、+4、-2 |
+5、-3 |
+3 |
+2 |
+1 |
| 原子半径(pm) |
64 |
66 |
77 |
104 |
110 |
143 |
160 |
186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题: (1)A、H、L对应离子的半径由大到小的顺序是(用离子符号表示);
(1)A、H、L对应离子的半径由大到小的顺序是(用离子符号表示); (2)A与L所形成的化合物的电子式;
(2)A与L所形成的化合物的电子式; (3)DB2的结构式为;
(3)DB2的结构式为; (4)D的最高正价氧化物与L的最高正价氧化物对应水化物X的溶液(足量)发生反应的离子方程式;
(4)D的最高正价氧化物与L的最高正价氧化物对应水化物X的溶液(足量)发生反应的离子方程式; (5)E的最高正价氧化物对应水化物y的浓溶液与Cu发生反应的化学方程式为
(5)E的最高正价氧化物对应水化物y的浓溶液与Cu发生反应的化学方程式为 。
。
有效地利用现有新能源和开发新能源已受到各国的重视。
(1)可用改进汽油组成的办法来改善汽油的燃烧性能。例如,在汽油中加入乙醇来生产“无铅汽油”。乙醇的分子式为C2H6O,试根据C、H、O成键的特点,写出C2H6O所有可能的结构式或结构简式 。
(2)天然气的主要的成分是甲烷,其燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一。能说明甲烷是正四面体而非正方形平面结构的理由是。(填写编号)
①其一氯取代物不存在同分异构体 ②其二氯取代物不存在同分异构体
③其三氯取代物不存在同分异构体④其四氯取代物不存在同分异构体
(3)氢能是人类未来的理想能源。1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h 的速度行驶了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列既可行又经济的制氢方法是 (填写编号)
的速度行驶了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列既可行又经济的制氢方法是 (填写编号)
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得纯氢气后,还需要解决的问题是。(写出其中的一个) (4)今有两个氢气燃烧生成水的热化学方程式
(4)今有两个氢气燃烧生成水的热化学方程式 2H2(g)+ O2(g) ="=" 2H2O(g)△H=a kJ/mol
2H2(g)+ O2(g) ="=" 2H2O(g)△H=a kJ/mol 2H2(g)+ O2(g) ==2H2O(l)△H=b kJ/mol
2H2(g)+ O2(g) ==2H2O(l)△H=b kJ/mol
请回答下列问题:(提示:︱b︱表示b的绝对值) ①若2 molH2完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)︱b︱kJ
①若2 molH2完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)︱b︱kJ
② 若已知拆开1mol氢气中的化学键要消耗436 kJ能量,拆开1mol氧气中的化学键要
若已知拆开1mol氢气中的化学键要消耗436 kJ能量,拆开1mol氧气中的化学键要 消耗496kJ能量,水蒸气中1molH—O键形成时放出热量463kJ,写出该反应的热化学方程式:
消耗496kJ能量,水蒸气中1molH—O键形成时放出热量463kJ,写出该反应的热化学方程式:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为;
(2)反应开始至2min,气体Z的平均反应速率为;
(3)若X、Y、Z均为气体,反应达平衡时,此时容器内的压强与起始压强之比为。