当前在人类已知的化合物中,种类最多的是
| A.ⅥA族元素的化合物 | B.ⅤA族元素的化合物 |
| C.ⅣA族元素的化合物 | D.ⅦA族元素的化合物 |
下列叙述不正确的是( )
| A.铁表面镀锌,铁作阳极 |
| B.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| C.钢铁吸氧腐蚀的阴极反应:O2+2H2O+4e-===4OH- |
| D.工业上电解饱和食盐水的阳极反应:2Cl--2e-===Cl2↑ |
X是一种性能优异的高分子材料,其结构简式为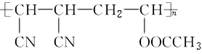 ,已被广泛应用于声、热、光的传感等方面。它是由
,已被广泛应用于声、热、光的传感等方面。它是由 、(CN)2、CH3COOH三种单体通过适宜的反应形成的。由X的结构简式分析合成过程中发生反应的类型有( )
、(CN)2、CH3COOH三种单体通过适宜的反应形成的。由X的结构简式分析合成过程中发生反应的类型有( )
①加成反应 ②消去反应 ③缩聚反应 ④加聚反应 ⑤酯化反应
| A.①④⑤ | B.①④ |
| C.②④ | D.①③ |
下面是一种线型高分子链的一部分: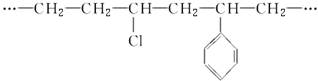
由此分析,此高聚物的单体最少有( )
| A.1种 | B.2种 |
| C.3种 | D.4种 |
关于塑料的下列说法中,正确的是( )
| A.塑料的主要成分是合成树脂,另外有少量具有某些特定用途的添加剂 |
| B.塑料是以石油、天然气为原料,以二烯烃和烯烃为单体聚合而成的高分子 |
| C.塑料制品容易被微生物分解,所以废弃塑料制品不会对环境造成严重的污染 |
| D.工程塑料具有某些优异的性能,但不可作为工程材料而代替某些金属 |
酚醛树脂可用苯酚和甲醛反应制得。实验室制备酚醛树脂时,在酸性条件下,苯酚过量制得的酚醛树脂若不易取出,则可趁热时加入一些乙醇来取出树脂;在碱性条件下,苯酚过量,若酚醛树脂不易取出时,用加热或加溶剂的方法都很难将树脂取出。在上述两种情况下,下列有关叙述正确的是( )
| A.酸性条件制得的是体型酚醛树脂,碱性条件制得的是线型酚醛树脂 |
| B.酸性条件制得的是线型酚醛树脂,碱性条件制得的是体型酚醛树脂 |
| C.两种条件下制得的都是线型酚醛树脂 |
| D.两种条件下制得的都是体型酚醛树脂 |