运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e-  H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g)  H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)  H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的  H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中
c(NH4+)=c(Cl-)。则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
亚硝酸盐是一种常见的食品添加剂,使用时必须严格控制其用量。为检测某食品中亚硝酸盐含量(通常以1kg样品中含NaNO2的质量计),某研究小组设计了如下两种实验方案:(提示 : 无色气体B遇空气显红棕色)
(1)甲方案②中常用做指示剂。若需配制80 mL0.001 mol·L-1的Na2S2O3标准溶液。现给出下列仪器(配制过程中可能用到):①50 mL烧杯②胶头滴管③天平④80 mL容量瓶⑤100 mL容量瓶⑥玻璃棒,按使用仪器的先后顺序排列正确的是
| A.③①⑤⑥② | B.③①⑥④② | C.③①⑥⑤② | D.③①④⑥② |
请写出配制Na2S2O3标准溶液时定容的操作
(2)已知酸性条件下MnO4—被还原为Mn2+,请写出乙方案①的离子方程式
(3)若取样品ag,按乙方案进行测定,准确量取12.00mL0.0005mol/L的酸性KMnO4溶液(过量)与溶液A反应。反应后溶液用0.0010mol/L(NH4)2Fe(SO4)2标准溶液滴定至溶液紫色刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液10.00mL.则1kg样品中 NaNO2的质量为_______mg.
(4)若乙方案②中使用的(NH4)2Fe(SO4)2溶液暴露在空气中时间过长,则会导致测定出的NaNO2含量(填“偏高”、“偏低”或“不影响”)
(5)小组经过讨论,认为方案更佳,原因是。
SO2、NO是大气污染物。工业上吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):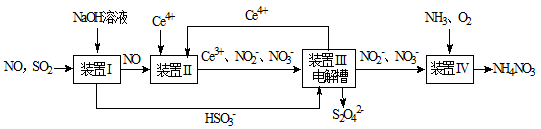
(1)装置Ⅰ中生成HSO3-的离子方程式为;
(2)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:;
(3)装置Ⅲ中,电解槽的阳极发生的电极反应为;
(4)从装置Ⅳ中获得粗产品NH4NO3的实验操作依次为、、过滤、洗涤等。
6-羰基庚酸是一种重要的化工中间体,其合成路线如下: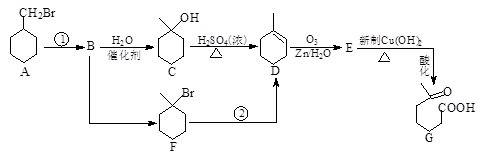
已知: 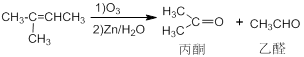
(1)反应①的条件是,C→D的反应类型是,C中官能团的名称是。
(2)下列说法中正确的是
a.C能被催化氧化成酮
b.D不能使酸性高锰酸钾溶液褪色
c.Ni催化下1mol E最多可与2molH2加成
d.G既能发生取代反应,又能发生加成反应
(3)E与新制Cu(OH)2反应的化学方程式为。
(4)G的同分异构体有多种。请写出三种结构中含有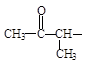 、且属于酯类的同分异构体:、、
、且属于酯类的同分异构体:、、
。
(5)已知“Diels-Alder反应”为: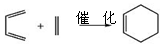 。物质D与呋喃(
。物质D与呋喃(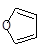 )也可以发生“Diels-Alder反应”,该化学反应方程式为: 。
)也可以发生“Diels-Alder反应”,该化学反应方程式为: 。
Na、Cu、Al、O、C、H是常见的六种元素。
(1)Al位于元素周期表第_____周期第_____族;Cu的基态原子价电子排布式为__________。
(2)用“>”或“<”填空:
| 第一电离能 |
离子半径 |
沸点 |
| Na_______Al |
O2—_______Na+ |
CH4______H2O |
(3)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 |
CH4 |
CO2 |
CO |
H2 |
| 体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=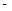 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="+2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=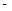 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________.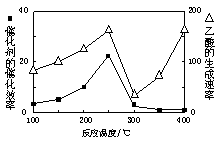
②为了提高该反应中CH4的转化率,可以采取的措施是__________________
(5)利用高温电解技术可将释放的CO2转化为具有工业利用价值的产品。
反应方程式为: ,其工作原理示意图如下:
,其工作原理示意图如下: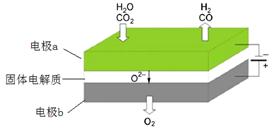
CO2在电极a放电的反应式是_______________________________
在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) 3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
(1)达到平衡时,C在反应混合气中的体积分数是(用含字母a的代数式表示);
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比(选填“增大”“减小”或“不变”);
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入Cmol。