填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号: 。
(2)周期表中位于第8纵行的铁元素属于第 族。
(3)周期表中最活泼的非金属元素位于第 纵行。
(4)所含元素超过18种的周期是第 、 周期。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为_________________;
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。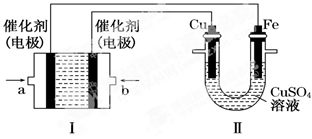
①a处应通入(填“CH4”或“O2”),a处电极上发生的电极反应式是_______________;
②电镀结束后,装置Ⅰ中KOH溶液的浓度(忽略溶液体积的变化)_______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有__________;
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液,请回答下列问题: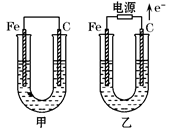
(1)甲池中碳极上电极反应式是________________,甲池铁极上电极反应属于。(填“氧化反应”或“还原反应”)
(2)写出乙池中总反应的离子方程式______________________。
(3)将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的Cl2将生成的I2又氧化。若反应的Cl2和I2物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为______________________________。
在2L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
600 |
800 |
830 |
1000 |
1200 |
| K |
0.25 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =。
(2)该反应为反应(选填“吸热”、“放热”)。
反应达平衡后,若再通入一定量CO2,则平衡常数K将________,CO2的转化率________。(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是。
(1)室温下,pH=13的NaOH溶液中,水电离出的c(H+)=a;pH=10的CH3COONa溶液中,水电离出的c(H+)=b,则a∶b=。
(2)中和相同体积、相同pH值的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同物质的量浓度的盐酸的体积分别为V1、V2、V3,则三者关系为 :。
(3)已知(NH4)2A溶液是中性,又知将H2A溶液加入到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的
pH7(选填“>”、“<”或“=”);
(4)氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有:;用离子方程式表示产生上述现象的原因。在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象,这种单质是(填字母)
| A.碳 | B.硫 | C.镁 | D.铜 |
(5)在含有Cl—、Br—、I—的溶液中,已知其浓度均为0.1mo1/L,已知AgCl、AgBr、AgI的溶度积分别为1.6×10—10、4.1×10—15、1. 5×10—16,若向混合溶液中逐滴加入AgNO3溶液,试回答:
①当AgBr沉淀开始析出时,溶液中Ag+浓度是。
②当AgCl沉淀开始析出时,溶液中的I—的浓度为:。
有下列物质:
(1)按系统命名法填写下列有机物的名称: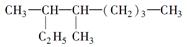 的名称是。
的名称是。
(2)2,6-二甲基-4-乙基辛烷的结构简式是,1mol该烃完全燃烧需消耗氧气________mol。
(3)今有化合物: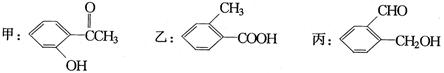
①请写出丙中含氧官能团的名称:。
②请判别上述化合物中甲与乙是否互为同分异构体:。(选填“是”或“否”)
(4)某气态不饱和烃对氢气的相对密度为27。0.54克该烃恰好与浓度为0.2mol・L—1的溴水100 mL完全反应,使溴水完全褪色。该烃的分子式为。由红外光谱知该有机物中含有碳碳三键,在核磁共振谱中有1个信号峰,该烃的结构简式为,写出该烃与氢气完全加成后所得物质的同分异构体的结构简式:。