A、B、C、D均为中学化学所学的常见物质,且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他产物已略去):请填写下列空白:
(1)若A为气体单质,则A为 ,D→B的离子方程式为
(2)若A为固体单质,则A为 ,A主要用于制造 (任写两种)
(3)若A为气体化合物,其水溶液能使湿润的红色石蕊试纸变蓝,则实验室制取A的化学方程式为 。
(4)若A为气体化合物,其水溶液能使湿润的蓝色石蕊试纸变红,则A为 ,A与B反应的化学方程式为 。
在容积为10 L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g) + H2O CO2(g) + H2(g)ΔH < 0。CO和H2O浓度变化如图所示。
CO2(g) + H2(g)ΔH < 0。CO和H2O浓度变化如图所示。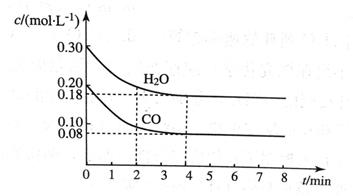
(1)则0~4 min内反应速率v(CO)为__________mol/(L·min);
(2)1000℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
1000℃时物质浓度的变化
| t/min |
c(CO)/(mol·L-1) |
c(H2O)/(mol·L-1) |
c(CO2)/(mol·L-1) |
c(H2)/(mol·L-1) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 1 |
0.138 |
0.238 |
0.062 |
0.062 |
| 2 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
| 5 |
0.116 |
0.216 |
0.084 |
0.084 |
| 6 |
0.096 |
0.266 |
0.104 |
0.104 |
①c1数值_____0.08 mol/L(填“<” “>” 或“=”);
②表中5~6 min之间数值发生变化,可能的原因是_______(填字母)。
a.增加水蒸气b.降低温度
c.使用催化剂 d.增加氢气浓度
在容积固定的密闭容器中,发生反应CO2(g) + H2(g)  CO(g) + H2O(g),化学平衡常数K和温度t的关系如下表:
CO(g) + H2O(g),化学平衡常数K和温度t的关系如下表:
| t/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为K = ______________________;
(2)该反应为_________反应(填“吸热”或“放热”。)
(3)能判断该反应达到化学平衡状态的是________(填字母)。
a.容器中总压强不变
b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等
d.c(CO2)= c(CO)
已知H2O(g) = H2(g) + 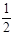 O2(g),反应过程中能量变化如图所示。请回答下列问题:
O2(g),反应过程中能量变化如图所示。请回答下列问题: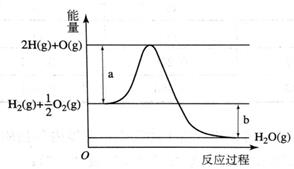
(1)图中a表示___________;
(2)该反应ΔH ______0(填“<”或“>”)。
(1)H2S溶于水的电离方程式为___________________________________________。
(2)①向H2S溶液中加入CuSO4溶液时,电离平衡向_________(填“正向”或“逆向”,下同)移动,c(H+)_______(填“增大”“减小”或“不变”,下同),c(S2-)________;
②向H2S溶液中加入NaOH固体时电离平衡向_________移动,c(H+)_______,c(S2-)________;
下列物质:①石墨 ②三氧化硫 ③液态氯化氢 ④氯气 ⑤熔融的硫酸钾 ⑥氯化钠晶体 ⑦硫酸溶液 ⑧乙醇 ⑨冰醋酸 ⑩NH3·H2O
其中能够导电的是______________________;(填序号,下同)
强电解质是____________________________;
弱电解质是____________________________;
非电解质是____________________________。