甲醇可通过将煤气化过程中生成的CO和H2在一定条件下,发生如下反应制得:CO(g)+2H2(g)  CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题: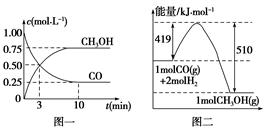
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= ,CO的转化率为 。
(2)该反应的平衡常数表达式为 ,温度升高,平衡常数 (填“增大”、“减小”或“不变”)。
(3)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则加入各物质后该反应向 (填“正”、“逆”)反应方向移动,理由是 。
(1)写出乙酸分子中官能团的电子式:。
(2)用最简单的方法鉴别苯、乙醇、溴苯,选用的试剂是:(填名称)
(3)下列五种化合物中,能够发生酯化、加成和氧化三种反应的是。
① CH2=CHCOOH② CH2=CHCOOCH3③ CH2=CHCH2OH
④ CH3CH2CH2OH⑤ HOCH2CH2CH2-
(4)某有机物的结构如图所示,关于该有机物的叙述不正确的是(填序号):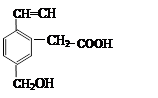
①可以燃烧;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤1mol该有机物最多能与1mol氢气加成;
⑥它属于芳香族化合物⑦能与溴的四氯化碳溶液在铁粉作催化剂的条件下发生取代反应
(8分)下表表示合成氨反应(N2+3H2 2NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)==1:3]。
2NH3)在不同条件下达到平衡时混合物中氨的含量[起始时v(N2):v(H2)==1:3]。
 压强(MPa) 压强(MPa) 氨的含量 氨的含量温度(℃) |
0.1 |
10 |
30 |
60 |
100 |
| 200 |
0.153 |
0.815 |
0.899 |
0.954 |
0.988 |
| 300 |
0.022 |
0.520 |
0.710 |
0.842 |
0.926 |
| 400 |
0.004 |
0.251 |
0.470 |
0.652 |
0.798 |
分析上表数据,回答下列问题:
(1)200℃、100MPa时,平衡混合物中氨的含量已达0.988,如果继续增大压强
(填“能”或“不能”)使平衡混合物中氨的含量等于1,理由是:
。
(2)欲使平衡混合物中氨的含量增大,则可采取的措施有:。
(3) 欲使平衡混合物中氨的含量为0.710,则选择的反应条件应为:
欲使平衡混合物中氨的含量为0.710,则选择的反应条件应为:
在以铁、铜为两电极的原电池中,如图所示: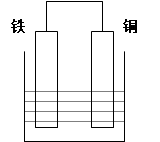
(1)若电解质溶液为稀硫酸,则铜电极上的电极反应式为:;原电池总反应的离子方程式:;
(2)若电解质溶液为浓硝酸,则铁电极上的电极反应式为:;当电路中通过了1mol的电子时,则在某极上生成了标准状况下的气体体积为:L。
现有A、B、C、D、E五种元素,都是短周期元素,其中A、B、C原子序数依次递增并都相差1。B的阳离子的电子层结构与Ne原子相同,2gB的氧化物与100ml 0.5mol/L的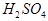 恰好完全反应。B单质与D单质反应后可形成离子化合物
恰好完全反应。B单质与D单质反应后可形成离子化合物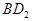 ;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
(1)五种元素的名称是B________;D;E________.
(2) 形成化合物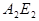 的化学键类型是:.
的化学键类型是:.
(3)用电子式表示化合物BD2的形成过程。.
(4) A的氢氧化物的水溶液和C单质发生反应的离子方程式: .
已知: H2O  H+ + OH-(△H>0),KW为水的电离常数,完成下表。
H+ + OH-(△H>0),KW为水的电离常数,完成下表。
| 改变条件 |
电离平衡移动方向 |
溶液中c(H+) |
PH的变化 |
KW |
|
| 升高温度 |
|||||
| 加入酸 |
|||||
| 加入Na |
|||||