元素性质呈周期性变化的决定因素是
| A.元素相对原子质量依次递增 | B.元素的最高正化合价呈周期性变化 |
| C.元素原子核外电子排布呈周期性变化 | D.元素金属性或非金属性呈周期性变化 |
下列物质中,属于含有极性键的共价化合物是
| A.CaCl2 | B.Cl2 | C.HCl | D.NaCl |
据报载我国最近合成多种元素的新的同位素,其中一种是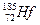 (铪),它的中子数是
(铪),它的中子数是
| A.72 | B.113 | C.185 | D.257 |
某金属氧化物的化学式为M2O3,电子总数为50,每个M离子具有10个电子。若每个氧原子核内都有8个中子,M2O3的相对分子质量为102,则M原子核内的中子数为
A.14 |
B.13 | C.10 | D.21 |
若两种元素原子的核外电子层数之比与最外层电子数之比相等,则在元素周期表的前10号元素中,满足上述关系的元素共有
| A.1对 | B.2对 | C.3对 | D.4对 |
下列说法不正确的是
①离子化合物不可能全部由非金属元素组成;②非金属单质中一定含有共价键;③共价化合物中可能含有离子键;④离子化合物中可能含有共价键;⑤非极性键只存在于非金属的双原子单质分子里;⑥不同元素组成的多原子分子里的化学键一定都是极性键
| A.①②④⑥ | B.②④⑤⑥ | C.①③⑤⑥ | D.只有④ |