下列离子方程式中正确的是
| A.向KAl(SO4)2溶液中加入Ba(OH)2至SO42–完全沉淀: 2Ba2+ + 4OH- + Al3+ + 2SO42-→2BaSO4↓+AlO2-+ 2H2O |
| B.用硫酸铜溶液吸收硫化氢气体: Cu2++S2-→CuS↓ |
| C.过量的Al2(SO4)3溶液加入NaAlO2溶液中: A13++3AlO2-+6H2O→4A1(OH)3↓ |
| D.向NaHCO3溶液中加入过量的Ba(OH)2溶液: |
Ba2++2HCO3-+2OH-→ BaCO3↓+CO32-+2H2O
现有浓度均为0.10mol·L-1的醋酸V1 mL和氢氧化钠溶液V2 mL,下列说法正确的是
| A.常温下,上述溶液中,醋酸溶液的pH=1,氢氧化钠溶液的pH=13 |
| B.常温下,若两溶液混合后pH=7,则混合液:c(Na+)=c(CH3COO-) |
| C.若 V1= V2,将两溶液混合,所得混合液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.V1与V2任意比混合,所得混合液:c (Na+)+ c(H+) =c(OH-)+ c (CH3COO-) |
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是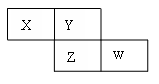
| A.气态氢化物的稳定性:X>Y |
| B.Z元素的氧化物对应的水化物一定是一种强酸 |
| C.X、Y、Z原子半径的大小顺序: X>Y>Z |
| D.X的气态氢化物与W的气态氢化物可以相互反应 |
设阿伏加德罗常数为NA,下列说法正确的是()
| A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B.1 mol NH3含有的电子数10NA |
| C.常温常压下,22.4L的氧气含氧原子数为2NA |
| D.常温下,1L0.1mol/L AlCl3溶液中含Al3+数为0.1NA |
以下物质间的每一步转化中,有不能通过一步反应实现的是
| A.SO2→SO3→H2SO4 | B.Al2O3→Al(OH)3→NaAlO2 |
| C.FeCl2→Fe(OH)2→Fe(OH)3 | D.NO→NO2→HNO3 |
下列反应的离子方程式正确的是
| A.FeCl3溶液腐蚀铜板电路:Fe3+ +Cu = Fe2+ + Cu2+ |
| B.碳酸钙溶于醋酸溶液:CaCO3 + 2H+ = Ca2++CO2↑+H2O |
| C.Ba(OH)2溶液与稀硫酸反应:Ba2+ + SO42-=BaSO4↓ |
| D.铜与稀硝酸反应:3Cu + 2NO3- + 8H+ = 3Cu2++2NO↑+4 H2O |