已知溶液中:还原性HSO3->I-,氧化性IO3-> I2 > SO42-。在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题: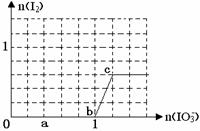
(1)写出a点反应的离子方程式 ;
反应中还原剂是 ;被还原的元素是 。
(2)写出b点到c点反应的离子方程式 。
(3) 当溶液中的I-为0.4 mol时,加入的KIO3为 mol。
当溶液中的I-为0.4 mol时,加入的KIO3为 mol。
(4)若往100 mL1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为
。
有甲乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
(1)甲平衡时A的体积分数为 ;
(2)若乙W%=40%,且建立平衡的过程中乙压强有变化 ,则x= ,乙中建立平衡时压强的变化为 (填“递增”或“递减”);
(3)若乙W%=40%,且平衡时甲、乙压强不同,则x= ,平衡时甲的压强 乙的压强(填“大于”或“小于”),乙平衡时c(A)= ;
(4)若x=4,则W% 40%(填“大于”、“小于”或“等于”,下同);平衡时乙中的c(A) 甲中的c(A)。
现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1
的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________;
(2)丙溶液中存在的所有电离平衡为_____________________________(用电离方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________;
有以下物质:①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩氯化氢气体。
(1)其中能导电的是 ;属于非电解质的是 ;属于强电解质的是 ;属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式: 。
(4)将物质⑥配制成溶液,逐滴加入⑦溶液中至沉淀量最大,写出离子方程式: ,检验离子沉淀完全的方法是 ,洗涤沉淀的方法是 。
在一定条件下,Fe2O3 + 3CO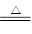 2Fe + 3CO2反应中, (填名称)是氧化剂, (填化学式)发生氧化反应, (填元素符号)元素被氧化,生成42g Fe时转移的电子的物质的量是mol .
2Fe + 3CO2反应中, (填名称)是氧化剂, (填化学式)发生氧化反应, (填元素符号)元素被氧化,生成42g Fe时转移的电子的物质的量是mol .
氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。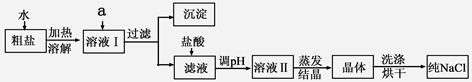
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、 、 ;
②在滤液中加盐酸的作用是 ;
(2)用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为 g。配制该溶液时所需要的玻璃仪器有