(12分)在右图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C,D为夹在滤纸两端的铂夹,X,Y分别为直流电源的两极。在A,B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入铂电极。切断电源开关S1,闭合开关S2,通直流电一段时间后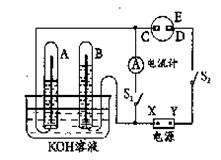
请回答下列问题:
(1)标出电源的正、负极:X为___极,Y为___极。
(2)在滤纸的C端附近,观察到的现象是_ ___,在滤纸的D端附近,观察到的现象是__ __。
(3)写出电极反应式:A中_ ___;B中_ ___;C中__ __;D中_ ___。
(4)若电解一段时间后,A、B中均有气体包围电极。此时切断开关S2,闭合开关S1,则电流计的指针是否发生偏转(填“偏转”或“不偏转”)__ __。
(5)若电流计指针偏转,写出有关的电极反应式(若指针“不偏转”,此题不必回答):
A中_____ ____ __ _;B中__ ________ __。
若电流计指针不偏转,请说明理由(若指针“偏转”,此题不必回答)____ __ ___ _ ____ __ __ _____ _ __ __ _ __ __。
氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。请回答下列各题:
用氢气和氮气合成氨是一个可逆反应,化学方程式如下:N2+3H2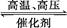 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
(1)请写出该反应的热化学方程式 。
(2)如果一个反应的ΔH-TΔS<0,则该反应能够自发进行。已知该反应的ΔS="-198.2" J·K-1·mol-1。则上述氨气的合成反应在常温下 (填“能”或“不能”)自发进行。
(1)科学家根据体系存在着力图使自身能量趋于 和由 变为 的自然现象,提出了互相关联的 判据和 判据,为最终解决“反应进行的方向”这一问题提供了必要的依据。
(2)在密闭条件下,体系有有序自发地转变为无序的倾向,因为与有序体系相比,无序体系更加稳定,科学家把这种因素称作 。
(3)判断下列过程熵变的正负(填“>0”或“<0”):
①溶解少量蔗糖于水中,ΔS ;
②纯碳和氧气反应生成CO(g),ΔS ;
③液态水蒸发变成水蒸气,ΔS ;
④CaCO3(s)加热分解生成CaO(s)和CO2(g),ΔS 。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t/℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是( )
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
Fe3+和I-在水溶液中的反应为:2I-+2Fe3+ 2Fe2++I2(水溶液)。
2Fe2++I2(水溶液)。
该反应的平衡常数K的表达式为K= 。当上述反应达到平衡状态后,加入CCl4萃取I2,且温度不变,上述平衡 移动(填“向右”“向左”或“不”)。
在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
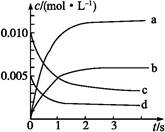
(1)上图表示NO2的浓度变化的曲线是 。用O2表示从0~2 s内该反应的平衡速率v= 。
(2)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变