常温下,将某一元酸HA和 NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号[ |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0. 1 1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸___________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等 于0.2________(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________
于0.2________(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________
____________________________
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=________mol·L-1 c(OH-)-c(HA)=________mol·L-1
在春夏之交的夜晚,墓地周围常出现“鬼火”,即磷火,这是尸骨中的Ca3P2与水反应生成PH3,PH3自燃的结果,写出Ca3P2与水反应的化学方程式:__________,再写出PH3发生自燃的化学方程式:_______________。
(1)舞台上的幕布与布景多是用浓NH4Cl溶液浸过制成的,可以防火,其原因是_____________________________。
(2)已知NH3结合H+的能力比结合Ag+的能力强。要使[Ag(NH3)2]+转化为自由的Ag+,应加入的试剂是_______,实现转化的离子方程式为______________________________________。
(3)氮的氧化物NOx与NH3反应生成N2和H2O,若在标准状况下1.5 L NOx和2 L NH3恰好完全作用,写出反应的化学方程式:____________________________,NOx中x值为___________。
根据下列变化进行推断:
已知强热A产生的气态物质的平均相对分子质量为26.3。
(1)推断A、B、C、D的化学式:A____________、B____________、C____________、D____________。
(2)写出①②变化的离子方程式。
一种无色澄清溶液可能含有K+、SO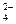 、NH
、NH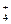 、Ba2+、H2PO
、Ba2+、H2PO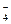 、NO
、NO 中的一种或几种,分别取少量溶液进行下列实验:①此溶液加入NaOH溶液有沉淀产生,加热产生一种使湿润红色石蕊试纸变蓝的气体。②另取原溶液浓缩后加入浓硫酸、铜片并加热,产生红棕色气体。由此可知此溶液中一定含有_______离子,一定不含有_______离子。
中的一种或几种,分别取少量溶液进行下列实验:①此溶液加入NaOH溶液有沉淀产生,加热产生一种使湿润红色石蕊试纸变蓝的气体。②另取原溶液浓缩后加入浓硫酸、铜片并加热,产生红棕色气体。由此可知此溶液中一定含有_______离子,一定不含有_______离子。
下图中①~ 分别代表有关反应中的一种物质,请填写以下空白。
分别代表有关反应中的一种物质,请填写以下空白。
(1)①③④的化学式分别是 、 、 。
(2)⑧与⑨反应的化学方程式是 。