化学能的转化在现实生活中得到了广泛的利用。回答以下问题:
(Ⅰ)(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧的热化学方程式: 。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1=" —702" kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2=" —182" kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3= 。
(3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 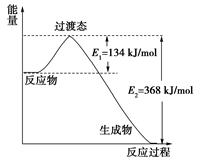
(Ⅱ)下图为相互串联的甲乙两个电解池: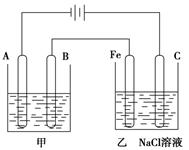
请回答:
(1)甲池若为用电解原理精炼铜的装置,则:
A极是 极,材料是 ,电极反应为 ,
B极是 极,材料是 ,电极反应为 ,
电解质溶液为 。
(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色。
(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积
_________________。
(4)同时若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为
__ _____。
近期国内外大量的研究表明,火灾中绝大多数人的第一死因并非高温烘烤或火烧,而是慌忙奔跑时吸入的烟雾中毒,且起火的建筑装修越豪华,这一特点越明显.聚氯乙烯是制作装修材料的最常用原料,失火后,随着火焰的剧烈跳动, 聚氯乙烯在不同的温度下,发生一系列的复杂化学变化,产生大量的有害气体,其大致过程如下:
请回答下列问题:
(1)火灾中由.聚氯乙烯产生的对人体有害气体,其化学成分主要有,你认为其中含量最大的为,在火灾现场,为防止气体中毒你应采取的防护措施是
(2)有机化学的基本反应类型有:
| A.加成反应 | B.消去反应 | C.取代反应 | D.重排反应4种,其中重排反应是指象CH2=CH-OH→CH3CHO的一类反应,请指出上述变化中下列所属的基本类型(填序号): |
①③
(3)在装修中广泛使用的粘合剂也是极易发生火灾的物质. 聚乙烯缩丁醛就是这样一种粘合剂,它是由聚乙烯醇( )与丁醛缩合脱水得到的含有六元环的高分子化合物,若已知反应:CH3OH+HCHO
)与丁醛缩合脱水得到的含有六元环的高分子化合物,若已知反应:CH3OH+HCHO CH3OCH2OCH3+H2O可以发生.
CH3OCH2OCH3+H2O可以发生.
请写出制取聚乙烯缩丁醛粘合剂的化学方程式_____________________
400K,1.01×105 Pa时,2L烃A的蒸气能在m L氧气中完全燃烧,反应后体积增至(m + 4)L(体积在同前的条件下测定)。
(1)烃A在组成上应满足的条件是____________________。
(2)当m = 15时,该烃可能的分子式为__________________。
(3)若A在常温常压下为气态,m的取值范围是__________________。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) 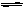 CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:
| t/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(填“吸热”“放热”)。
为体现绿色世博、低碳世博、科技世博,上海世博会已经开始使用中国自己生产的燃料电池汽车,该车以氢气和空气中的氧气为燃料,KOH为电解质溶液,真正实现了“零排放”。该电池的负极反应式为,从能量角度分析氢气用作燃料电池与直接燃烧相比主要优点是。
t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A (g)+B (g)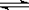 x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)v(B) =mol/(L·min),v(C) =mol/(L·min),x=。
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变