拆开1mol H—H键,1mol N—H键,1mol N三N键分别需要吸收的能量为436kJ ,391kJ,946kJ:则理论上,每生成1mol NH3, 热量(填:吸收或放出) kJ;事实上,反应的热量总小于理论值,为什么?
物质的类别和核心元素的化合价是研究物质性质的两个重要视角。硫及其化合物与价态变化为坐标的二维转化关系如图所示。完成下列填空:
(1)图中X的水溶液在空气中放置易变浑浊,写出反应的化学方程式:;
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度
分析,理论上有可能实现的方案是 (选填编号)。
a.Na2S + S b.Z + S c.Na2SO3 + Y d.NaHS + NaHSO3
(3)请补充完整焙烧明矾的化学方程式:
___KAl(SO4)2·12H2O +____S = ____K2SO4 + ____Al2O3 + ____SO2↑ +
(4)研究反应Na2S2O3 + H2SO4 ="=" Na2SO4 + S↓ + SO2↑+ H2O的速率时,下列方案合理的是(选填编号)。
a.测定一段时间内生成SO2的体积,得出该反应的速率
b.研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c.用Na2S2O3(s)分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(5)治理含CO、SO2的烟道气,以铝钒土做催化剂,将CO、SO2在380℃时转化为S 和一种无毒气体。已知:①硫的熔点:112.8℃、沸点:444.6℃;
②反应每得到1mol硫,放出270kJ的热量。写出该治理烟道气反应的热化学方程式。
(6)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图。不考虑催化剂价格因素,生产中选铝矾土做催化剂的主要原因是。
(原创)化学反应原理在生产和科研中有着重要的应用,请利用相关知识回答下列问题。
(1)一定条件下在密闭容器中加入NH4I发生反应:
a.NH4I(s)  NH3(g)+HI(g)
NH3(g)+HI(g)
b.2HI(g)  H2(g)+I2(g)
H2(g)+I2(g)
则反应a的平衡常数表达式为_______;达到平衡后,扩大容器体积,反应b的移动方向_______(填正向、逆向或不移动)
(2)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2 N2O4△H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
N2O4△H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
| A.b点的操作是压缩注射器 |
| B.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| C.若反应在一绝热容器中进行,则b、c两点的平衡常数Kb>Kc |
D.d点: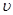 (正)> (正)> 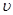 (逆) (逆) |
(3)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
①电极a为______极,其电极反应式为________________
②当有2.24 L NO2(标准状况下)被处理时,转移电子为____________mol
③为使电池持续放电,该离子交换膜需选用_______(选填“阳”或“阴”)离子交换膜。
(4)使用硼氢化钠(NaBH4)为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式______________________________。
②在纳米钴的催化作用下,肼(N2H4)可分解生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,为抑制肼的分解,可采取的合理措施有_________________________________ (任写一种)。
【化学一选修3:物质结构与性质】(15分)
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、 (PAN)等二次污染物。
(PAN)等二次污染物。
①1mol PAN中含有的σ键数目为_______。PAN中除H外其余三种元素的第一电离能由大到小的顺序为_________________。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为_______,中心离子的核外电子排布式为_______________。
③相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是___________________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。
a.离子键
b.共价键
c.配位键
d.范德华力
e.氢键
②NH4NO3中阳离子的空间构型为_____,阴离子的中心原子轨道采用_______杂化。
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。
【化学一选修2:化学与技术】(15分)纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装人氯化炉中,在髙温下通人Cl2,制得混有SiCl4杂质的TiCl4。
Ⅱ.将混有SiCl4杂质的TiCl4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O。
Ⅳ.TiO2•xH2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是。Ⅱ中所采取的操作名称。
②如实验IV中,应将TiO2•xH2O放在(填仪器编号)中加热。
(2)据报道“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下: .O2 → 2O
.O2 → 2O  .O + H2O → 2OH(羟基)
.O + H2O → 2OH(羟基)  .OH + OH → H2O2
.OH + OH → H2O2
① b中破坏的是(填“极性共价键”或“非极性共价键”)。
② H2O2能清除路面空气中的CXHY、CO等,其主要是利用了H2O2的_(填“氧化性”或“还原性”)。
(3)过氧化氢是重要的化学试剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。请填写下列空白:
①取10.00mL密度为 g/mL的过氧化氢溶液稀释至250mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数配平及化学式填写在方框里。
g/mL的过氧化氢溶液稀释至250mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数配平及化学式填写在方框里。
MnO4- + H2O2 + H+ ="=" Mn2+ + H2O + 
②滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是。
③重复滴定三次,平均耗用cmol/L KMnO4标准溶液VmL,则原过氧化氢溶液中过氧化氢的质量分数为。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果(填“偏髙”或“偏低” 或“不变”)。
(15分)工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素)。
请回答下列问题:
(1)装置I中生成HSO-3的离子方程式为。
(2)含硫各微粒(H2SO3、HSO-3和SO2-3)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如下图所示。
①下列说法正确的是(填标号)。
| A.pH = 7时,溶液中c( Na+) < c (HSO-3) + c(SO2-3) |
| B.由图中数据,可以估算出H2SO3的第二级电离平衡常数K2≈10-7 |
| C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜 |
| D.pH = 9时溶液中 c(OH-)=" c" (H+) + c(HSO-3)+ 2c(H2SO3) |
②向pH = 5的NaHSO3溶液中滴加一定浓度的 CaCl2溶液,溶液中出现浑浊,其pH 降为2 ,用化学平衡移动原理解释溶液 pH 降低的原因。
(3)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO-2离子方程式。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
图中A为电源的(填“正”或“负”)极。右侧反应室中发生的主要电极反应式为。
(5)已知进人装置Ⅳ的溶液中NO-2的浓度为 0.75 mol/L ,要使 1m3该溶液中的NO-2完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L 。