X~R是元素周期表中的短周期元素,其性质或结构信息如下表:
| 元素 |
X |
Y |
Z |
W |
R |
| 性质 信息 |
能形成+7价的化合物 |
日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 |
通常状况下能形成短周期中最稳定的双原子分子 |
焰色反应为黄色 |
位于第IVA,是形成化合物种类最多的元素 |
请用化学用语回答下列问题:
(1)X在元素周期表中的位置是_______。
(2)元素W的离子结构示意图为_________。
(3)元素R的最高价氧化物的电子式为_________。
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型为_____,_____。
(5)含Y的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是 。(用离子方程式表示)
(6)W的氢氧化物是重要的基本化工原料。写出工业上制取该氢氧化物的离子反应方程式_____。
2A B + C在某一温度时,达到平衡。
B + C在某一温度时,达到平衡。
(1)若温度升高,平衡向正反应方向移动,则正反应是___________反应(填放热或吸热);
(2)若B为固体,降低压强平衡向逆反应方向移动,则A呈___________态;
(3)若A是气态时,加压时,平衡不移动,则B为_________态,C为__________态;
(4) 若A、B、C均为气体,加入催化剂,平衡___________移动(填正向、逆向、不)
、(1)写出下列反应的热化学方程式
①1molN2 (g)与适量O2 (g)反应生成NO(g),需吸收68kJ的热量
②1g 硫粉在氧气中充分燃烧放出 9.36kJ热量
(2)氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
①若电解质溶液为KOH,其正极反应方程式为:
②若电解质溶液为硫酸,负极反应方程式为:。
(12分)在右图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C,D为夹在滤纸两端的铂夹,X,Y分别为直流电源的两极。在A,B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入铂电极。切断电源开关S1,闭合开关S2,通直流电一段时间后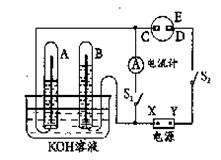
请回答下列问题:
(1)标出电源的正、负极:X为___极,Y为___极。
(2)在滤纸的C端附近,观察到的现象是____,在滤纸的D端附近,观察到的现象是____。
(3)写出电极反应式:A中____;B中____;C中____;D中____。
(4)若电解一段时间后,A、B中均有气体包围电极。此时切断开关S2,闭合开关S1,则电流计的指针是否发生偏转(填“偏转”或“不偏转”)____。
(5)若电流计指针偏转,写出有关的电极反应式(若指针“不偏转”,此题不必回答):
A中____________;B中____________。
若电流计指针不偏转,请说明理由(若指针“偏转”,此题不必回答)_________________________________。
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ⊿H
CH3OH(g) ⊿H
已知某些化学键的键能数据如下表:
| 化学键 |
C—C |
C—H |
H—H |
C—O |
C≡O |
H—O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,该反应的⊿H = ;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
| 压强/MPa |
12.6 |
10.8 |
9.5 |
8.7 |
8.4 |
8.4 |
则从反应开始到20min时,以CO表示的平均反应速率=,该温度下平衡常数K=,若升高温度则K值(填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是;
A、容器内气体的平均摩尔质量保持不变
B、2v(H2)正=v(CH3OH)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO的同时生成2nmolH2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如右,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l),则负极的电极反应式为。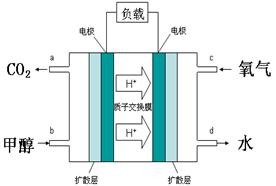
红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)根据上图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式;
(2)PCl5分解生成PCl3和Cl2的热化学方程式;
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于;
若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2α1 (填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是;
(4)P和Cl2分两步反应生成1mol PCl5的△H3=;P和Cl2一步反应生成1mol PCl5的△H4△H3(填“大于”,“小于”或“等于”);