对于某些离子的检验及结论一定正确的是
| A.SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性 |
| B.加入NaOH溶液,生成的白色沉淀在空气中迅速变为灰绿色,最终变为红褐色,则原溶液中一定含有Fe2+ |
| C.加入Ba(NO3)2溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液一定有SO42- |
| D.用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+ |
下表各组物质中,物质之间通过一步反应就能实现如图所示转化的是()
 物质 物质选项 |
a |
b |
c |
d |
| A |
Al |
Al(OH)3 |
NaAlO2 |
NaOH |
| B |
CH3CH2OH |
CH3CHO |
CH3COOH |
O2 |
| C |
Na2CO3 |
NaHCO3 |
NaOH |
CO2 |
| D |
Cl2 |
FeCl3 |
FeCl2 |
Fe |
三聚氰酸C3N3(OH)3可用于消除汽车尾气中的氮氧化物。当加热至一定温度时,它分解产生的HNCO(异氰酸,其结构是H-N=C=O)能和NO2反应:HNCO+NO2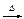 N2+CO2+H2O(未配平)。下列关于该反应的叙述正确的是()
N2+CO2+H2O(未配平)。下列关于该反应的叙述正确的是()
| A.N2是还原产物,CO2是氧化产物 |
| B.每生成1 molCO2需转移12 mol电子 |
| C.反应中氧化剂和还原剂的物质的量之比为3:2 |
| D.N元素既被氧化,也被还原 |
设NA为阿伏加德罗常数的值,下列有关叙述中正确的是()
A.标准状况下,密度为dg/L的某纯净气体一个分子的质量为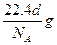 |
| B.标准状况下,11.2LCCl4中含有的C-Cl键的数目为2NA |
| C.17g的氢氧根离子中含有的电子数为9NA |
| D.用100 mL 18.4 mol·L-1的浓硫酸与足量的铜反应,生成SO2的分子数为0.92NA |
下列各组离子在指定溶液中能大量共存的是()
| A.无色溶液中:K+、Na+、MnO4-、SO42- |
| B.加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ |
| C.由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| D.有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
下列装置能达到实验目的的是()
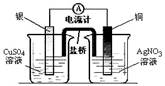
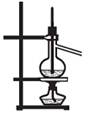

①② ③ ④
| A.实验室用装置①制取氨气 |
| B.装置②将化学能转化为电能 |
| C.装置③可用于分离沸点相差较大的互溶液体混合物 |
| D.装置④中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |