基于下列各现象或事实,对其原理的解释中,合理的是
| A.漂白粉长期暴露在空气中变质:漂白粉的主要成份被空气中的氧气氧化 |
| B.浓硫酸敞口露置于空气中质量分数减小:浓硫酸吸收空气中的水分 |
| C.常温时将铜片放入稀硫酸中无明显现象:产生了“钝化”现象 |
| D.亚硫酸钠溶液能使溴水褪色:亚硫酸钠具有强氧化性 |
下列提纯物质方法正确的是
| A.用BaCl2溶液除去HNO3溶液中的少量H2SO4 |
| B.用NaOH溶液除去铝粉中的少量铁粉 |
| C.用氯水除去FeCl2溶液中的少量FeCl3 |
| D.用加热法除去NaCl固体中的少量NH4Cl |
下列实验操作合理的是
| A.用酒精萃取碘水中的碘 | B.用托盘天平称取5.20 g氯化钠 |
| C.用100 mL量筒量取5.20 mL盐酸 | D.用坩埚灼烧干海带得到海带灰 |
实验是化学研究的基础。对下列实验现象的描述错误的是
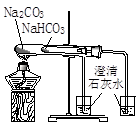 |
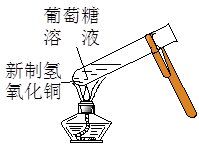 |
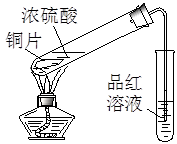 |
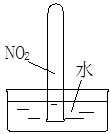 |
| ① |
② |
③ |
④ |
A.实验①烧杯中的澄清石灰水都变浑浊
B.实验②试管中出现砖红色沉淀
C.实验③品红溶液褪色
D.实验④气体由红棕色变为无色,试管中的液面上升
对下列物质用途的描述不符合事实的是
| A.氯水可以漂白杀菌 | B.铝制容器可以贮运稀硝酸 |
| C.过氧化钠可用作潜艇供氧剂 | D.Fe2O3可用作外墙涂料 |
下列化学用语正确的是
A.乙烯分子的电子式 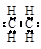 |
B.硫原子的结构示意图  |
| C.淀粉的化学式 (C6H10O5)n |
| D.硫酸铁的电离方程式 Fe2(SO4)3 = 2Fe2+ + 3SO42ˉ |