写出下列为物质的电子式:
O(原子) H2S CaCl2 NaOH HClO
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: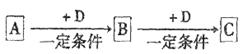
(1)若A能使湿润的红色石蕊试纸变蓝,C为红棕色气体。则实验室常用的制取A的化学方程式为,A转化为B的化学方程式为。
(2)若组成D单质的元素在地壳中含量最高,A元素焰色反应为黄色,则C的电子式为。
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(只用离子方程式说明)________________,A与D反应的化学方程式是。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为。
(5)若D为一种强碱,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为。
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
| X |
Y |
|
| Z |
W |
(1)元素Z位于周期表中第周期,族;
(2)这些元素的氢化物中是结构最简单的有机物(写化学式);
(3)Y的最高价氧化物的化学式为;
(4)XW2的电子式为;其遇水在高温时发生非氧化还原反应,得到两种酸性气体,该反应的化学方程式为:
(5)用电子式表示Na2W的形成过程;
(6)W和Y形成的一种化合物相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为。
现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气。
试回答:
(1)写出元素C、E的名称:C;E。
(2)画出A的原子结构示意图,B的离子结构示意图,D的单质分子的电子式。
(3)写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
;。
(4)比较B、C、E三种元素形成的简单离子半径的大小和氧化性的强弱(用离子符号表示):离子半径:;氧化性:。
(5)写出E与冷水反应的化学方程式:。
根据下表所列信息,回答有关问题:
| 周期 |
族 |
|||||||
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 四 |
⑩ |
⑾ |
⑿ |
(1)写出下列元素符号:①,⑥,⑦,⑾。
(2)在这些元素中,最活泼的非金属元素是(填写元素符号或化学式,下同),最活泼的金属元素是,最不活泼的元素是。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是,碱性最强的是,呈两性的氢氧化物是。
(4)在这些元素中,原子半径最小的是。
(5)在③与④的单质中,化学性质较活泼的是;在⑧与⑿的单质中,化学性质较活泼的是。
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)△H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O