今有三种物质AC2、B2C2、AD4,且AC2为气体,元素A的最高正价和最低负价绝对值相等,元素B的单质能在C的气态单质中剧烈燃烧,产物在常温下为液态,元素D的负一价阴离子电子层结构与氖原子相同,则:
(1)A、B、C、D的元素名称分别为:A____ B____ C____ D____。
(2)AC2分子内含________键,属________分子
AD4分子内含________键,属________分子
(10分)下列物质之间能够发生如图所示的化学反应,合金由两种金属组成,取C溶液进行焰色反应则火焰呈黄色。在反应中产生的水均未在图中标出。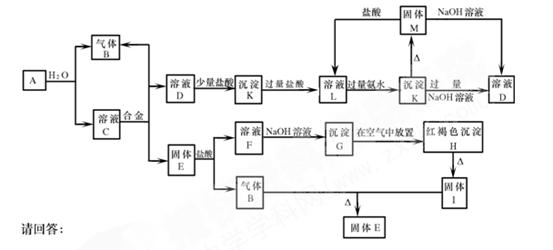
(1)写出下列物质的化学式:A:M:H:
(2)写出下列反应的化学方程式,并标出电子转移情况:
G→H:
(3)写出下列反应的离子方程式:
A→B+C:
K→D:
(6分)"比较"是化学研究物质性质的基本方法之一,请运用比较法解答下列问题
已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如:2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3。
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式。
(2)当1molSO3参加反应时,转移电子的物质的量为mol。
(3)通过比较可知:在氧化物中,当非金属元素处于价时,其氧化物与过氧化钠反应就有O2生成 。
。
(4分)就有关物质的分离回答下面的问题
(1)现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/oC |
沸点/oC |
密度/g·cm-3 |
溶解性 |
| A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是:
(2)在分液漏斗中用一种有机溶剂萃取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是"水层",试设计一种简便的判断方法。答:
氧化还原反应的本质是,通常可用元素化合价的升降来判断氧化剂、还原剂。所含元素化合价升高的物质是剂,发生反应。
标准状况下1.68L无色可燃气体在足量氧气中完全燃烧。若将产物通足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g。
(1)燃烧产物中生成水的质量是克;
(2)若原气体是单一气体,则它的分子式是;
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式(只要求写出一组)。