能源问题是当前世界各国所面临的严重问题,同时全球气候变暖,生态环境问题日益突出,开发氢能、研制燃料电池、发展低碳经济是化学工作者的研究方向。
I.氢气通常用生产水煤气的方法制得。其中CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
△H<0。在850℃时,平衡常数K=1。
(1)若降低温度到750℃时,达到平衡时K 1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3molH2O、1.0molCO2
和x molH2,则:
①当x=5.0时,上述反应向 (填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,
测得H2的体积分数分别为a%、b%,则a b(填“大于”、“小于”或“等于”)
II.已知4.6g液态乙醇完全燃烧生成二氧化碳和液态水放出热量136kJ·mol液态水转
化为气体水吸收44kJ的热量。
(3)请写出乙醇燃烧生成气态水的热化学方程式
。
(4)将0.1mol乙醇在足量氧气中燃烧,得到的气体全部通入到100mL3mol/LNaOH溶液中,忽略HCO-3的电离,则所得溶液中c(CO2-3) c(HCO-3)(填“大于”、“小于”或“等于”,)原因是 (用文字叙述)。
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适的氧化剂,使Fe2+被氧化为Fe3+,下列物质可采用的是________。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A.NaOHB.KOHC.CuO D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4不一定能达到除去Fe3+而不损失Cu2+的目的。乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________。(填“可行”或“不可行”)。
已知25°C时:
| 电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶度积 |
1.8×10-11 |
2.2×10-20 |
8.0×10-16 |
4.0×10-38 |
| 完全沉淀时的pH |
9.7 |
5.0 |
5.5 |
4.0 |
在物质的提纯中,常利用难溶电解质的沉淀溶解平衡原理除去某些离子。例如:
①为了除去氯化铵晶体中的氯化铁杂质,先将混合物溶于水,再加入一定量的试剂a进行反应,过滤结晶即可;
②为了除去氯化镁晶体中的氯化铁杂质,先将混合物溶于水,再加入足量的氢氧化镁充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的硫酸亚铁杂质,先将混合物溶于水,再加入一定量的双氧水,将亚铁离子氧化,然后加入试剂b调节溶液的pH=4,过滤结晶即可。
(1)上述三种除杂方案都将Fe2+、Fe3+转化为________(填化学式)而除去。
(2)试剂a为________。
(3)写出②中除杂所发生的总反应的离子方程式:________。
(4)下列与方案③有关的叙述正确的是________(填字母序号)。
A.H2O2是绿色氧化剂,在氧化过程中不引入杂质,不产生污染
B.将亚铁离子氧化的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4的试剂b是氢氧化铜或氧化铜
D.在pH大于4的溶液中Fe3+已完全不存在
Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 |
HA的物质的量浓度(mol·L-1) |
NaOH的物质的量浓度(mol·L-1) |
混合后溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?________。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是________。
c(Na+)-c(A-)=________mol·L-1
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-、HB- H++B2-。
H++B2-。
回答下列问题:
(5)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈________(填“酸性”、“中性”或“碱性”),溶液中c(Na+)________c(CH3COO-)(填“>”、“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈________(填“酸性”、“中性”或“碱性”),溶液中c(Na+)________c(CH3COO-)(填“>”、“=”或“<”)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中CH3COO-和Na+浓度相等,则混合后溶液呈________(填“酸性”、“中性”或“碱性”),醋酸体积________氢氧化钠溶液体积(填“大于”、“等于”或“小于”)。
已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)用离子方程式解释NaHC2O4溶液显酸性的原因:________________。
(2)常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,比较所得溶液中各种离子浓度的大小关系:________________。
(3)配平以下氧化还原反应方程式。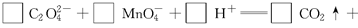
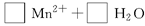
(4)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份该溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加20 mL 0.25 mol/L NaOH溶液时,溶液由无色变为浅红色。该溶液中被中和的H+的物质的量为________mol。
②第二份溶液中滴加16mL 0.10mol/L酸性KMnO4溶液时反应完全,该溶液中还原剂的物质的量为________mol。
③原试样中H2C2O4·2H2O的物质的量为________mol,KHC2O4的质量分数为________。