A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。
A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
请填空:
(1)形成单质A的原子的结构示意图为,它的最高化合价为。
(2)B的化学式(分子式)为,B的晶体类型为。
B和碳反应生成A和E的化学方程式是。
(3)C的化学式(分子式)为,D的化学式(分子式)为。
BAD是一种紫外线吸收剂,其合成方法如下: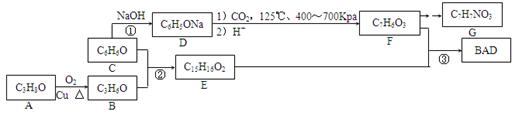
已知:
Ⅰ、B分子中所有H原子的化学环境相同;
Ⅱ、BAD的结构为: 。
。
请回答下列问题:
(1)A的名称为。
(2)F的结构简式为。F的一些同分异构体能使氯化铁溶液变色,能发生银镜反应,且苯环上的一硝基取代产物有两种。符合上述条件的同分异构体有种。
(3)反应②的化学方程式为;反应③在一定条件下能直接进行,其反应类型为。
(4)G是一种氨基酸,且羧基和氨基处于苯环的对位。写出G缩聚产物可能的结构简式(只要求写一种)。
A、B、C、D、G 都是含有同一种短周期元素的化合物,E是氧化物,H是单质,D是常见的强酸,反应①、②、③ 是工业生产中的重要反应,根据下图转化关系(反应条件及部分产物已略去)填空:
(1)若A、B、C、D、G 均含X 元素,且A 的一个分子中只含有10 个电子,G 是复合肥料,则反应①、②、③ 是工业生产__________________的基本原理,M 的化学式是__________。反应④的离子方程式是__________________________。
(2)若A、B、C、D、G均含Y元素,Y 元素处于X的相邻周期、相邻族,A为黄色固体,G可作净水剂,则M元素在周期表中的位置是_____________________。其中反应①的化学方程式是_____________________;将2.5t含85%A的矿石(杂质不参加反应)煅烧时,A中的Y元素有5.0%损失而混入炉渣,计算可制得98%的D的质量t。
一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)=。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是(填序号)。
| A.升高温度 | B.增大压强 | C.充入一定量氮气 | D.再加入一些铁粉 |
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeSO4溶液与稍过量的NH4HCO3溶液混合,可得含FeCO3的浊液。若FeCO3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO3生成红褐色物质的反应的化学方程式:。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为。
(5)已知:2CO(g) + O2(g) ="=" 2CO2(g);△H=-566 kJ·mol-1
2H2(g) + O2(g) ="=" 2H2O(g);△H=-483.6 kJ·mol-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:
。
铁和铜作为常见金属,在生活中有着广泛的应用。
(1)硫酸铁在工业上可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。(CuFeS2中S为-2价)则下列说法正确的是(选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1mol电子时,46 g CuFeS2参加反应
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI + Hg = Cu2HgI4 + 2Cu,以上反应中的氧化剂为______; CuI可由Cu2+与I 直接反应制得,请配平下列反应的离子方程式:Cu2+ + I
直接反应制得,请配平下列反应的离子方程式:Cu2+ + I — CuI + I
— CuI + I