有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。X为周期表前四周期中电负性最小的元素,Z的原子序数为28。
请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
⑴ 写出QT2+的电子式______、基态Z原子的核外电子排布式______。
⑵ Q的简单氢化物极易溶于T的简单氢化物,其主要原因有______等两种。
⑶ 化合物甲由T、X两元素组成,其晶胞如图1,甲的化学式为______。
⑷化合物乙的晶胞如图2,乙由E、Q两元素组成,硬度超过金刚石。
①乙的晶体类型为______。
②乙的晶体中E、Q两种元素原子的杂化方式均为______。
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为 ___________
(2)反应开始至2min、5minZ的平均反应速率为 、 ;
(3)5min后Z的生成速率比5min末Z的生成速率 (填写“大、小或相等”)。
1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应的中和热为_______,表示该中和热的热化学方程式为________
如右图所示装置为在直流电流作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则: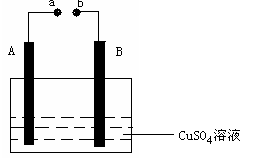
(1)a为电源的 极。B叫电解槽的 极,电路中流过的电子的数目为
(2)写出电极反应方程式:A ,B 。
(3)如果想使反应溶液恢复到原来状态,应该加入 g
家用炒菜铁锅用水清洗放置后,便会因腐蚀而出现红棕色的锈斑,铁锅发生腐蚀应属于 腐蚀,负极反应式为 ,正极反应式为 ,
为除去粗盐中的CaCl2、MgCl2、FeCl3、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)上述实验中第⑤步操作需要烧杯、____________、___________等玻璃仪器。
(2)判断BaCl2已过量的方法是 。
(3)第④步中所有相关的化学方程式是 、 。
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是 。