现有①BaCl2②金刚石③金属铜④KOH ⑤干冰⑥纯硫酸⑦二氧化硅⑧白磷⑨K2O⑩NH4Cl十种物质,按下列要求回答(填序号):
⑴熔化时需要破坏共价键的是 ;⑵属于分子晶体的是 ;
⑶固体不导电,常压下熔化时能导电的是 ;⑷④的电子式 。
下列有关有机化学实验的叙述正确的是。(填序号)
①向电石中滴加饱和食盐水制取乙炔气体。
②1-氯丁烷在NaOH水溶液中,可以发生消去反应生成1-丁烯
③可向皂化反应后的混合液中,加入饱和食盐水,使肥皂析出
④酒精与浓H2SO4的混合物,加热到140℃可以制取乙烯
⑤向淀粉溶液中加入少量稀硫酸,加热使淀粉水解,再加入银氨溶液,加热,检验淀粉是否发生水解
环己烷可制备1,4-环己二醇,下列七步有关反应(其中无机产物都已经略去)中,其中有两步属于取代反应,两步属于消去反应,三步属于加成反应,试回答:
(1)写出下列化合物的结构简式:
B:C:
(2)反应④所用的试剂和条件分别为:
(3)写出①、④的化学方程式:
①:;④:
(6分)(1)某反应过程中的能量变化如下图所示: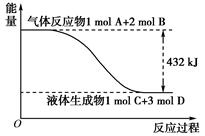
写出该反应的热化学方程式_____________________________________________。
(2)在溶液中进行的化学反应的物质,其状态标为“aq”,已知含0.2 mol HCl的溶液与足量氢氧化钠溶液反应放出11.46 kJ的热量,用离子方程式写出中和热的热化学方程式____________________________________________________________________。
(12分)实验测得,某有机物相对分子质量为72。
(1)若该有机物是烃,其分子式为_________,它有______种同分异构体。若该烃与Cl2发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为_____________。
(2)若该有机物3.6g完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为_______。若它是一种不饱和羧酸,该酸与甲醇发生酯化反应的化学方程式为(注明反应条件):________,
若它是一种不饱和酯,该酯发生加聚反应的生成物的结构简式为_______________。
请设计一个方案,证明苯酚、碳酸、乙酸的酸性依次增强(所需的试剂自选,只用两个化学方程式表示即可)。
;。