在体积固定为2 L的密闭容器中,A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化情况如图甲所示。下列有关说法不正确的是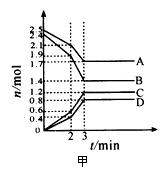
A.该反应的化学方程式为4A + 5B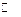 6C + 4D
6C + 4D
B.前2 min用B表示的反应速率约为0.0021 mol·L-1·s-1
C.2 min时,外界条件的改变可能是升高温度或加入了催化剂
D.若起始时只加入A、B且物质的量分别为1.6 mol和2.0 mol,则达平衡时A、B的转化率不相等
下列化学实验事实及其解释都正确的是
| A.因为Ksp(CaCO3)<Ksp(CaSO4),所以可用Na2CO3和HCl除去水垢中的CaSO4 |
| B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| C.滴有酚酞的碳酸氢钠溶液呈浅红色,微热后红色加深,是因为碳酸氢钠分解生成了碳酸钠 |
D.硫化钠溶于水中发生反应的离子方程式为S2 –+ 2H2O H2S + 2OH – H2S + 2OH – |
有①CH3COOH、②HCl、③H2SO4三种溶液,下列说法不正确的是
| A.pH相同时,其物质的量浓度由大到小的顺序是①>②>③ |
| B.物质的量浓度相同时,其pH由大到小的顺序是①>②>③ |
| C.中和等量的烧碱溶液,需等物质的量浓度的①②③三种酸溶液的体积比为2∶2∶1 |
| D.体积和物质的量浓度均相同的①②③三溶液 ,分别与同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积比为2∶1∶2 |
铜锌原电池(如右图)工作时,下列叙述错误的是 
| A.盐桥中的K+移向ZnSO4溶液 |
| B.电池总反应为:Zn+Cu2+==Zn2++Cu |
| C.在外电路中,电子从负极流向正极 |
| D.负极反应为:Zn-2e-==Zn2+ |
某同学写出的下列烷烃的名称正确的是
| A.2,5-二甲基-3-乙基己烷 | B.2-甲基-4-乙基戊烷 |
| C.1,2-二甲基戊烷 | D.3-甲基-4-乙基戊烷 |
下列有关化学用语表示正确的是
A.羟基的电子式 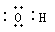 |
B.丙烯的球棍模型  |
C.乙炔的电子式 H∶C C∶H C∶H |
D.乙酸的实验式 C2H4O2 |