A、B、C、D、E 是五种短周期元素,原子序数依次增大。前四种的原子序数之和是E的原子序数的二倍。E的阳离子与D的阴离子都比A阳离子多2个电子层。D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物。B是形成化合物种类最多的元素。请回答下列问题:
是五种短周期元素,原子序数依次增大。前四种的原子序数之和是E的原子序数的二倍。E的阳离子与D的阴离子都比A阳离子多2个电子层。D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物。B是形成化合物种类最多的元素。请回答下列问题:
(1)写出元素符号:A________,E________。
(2)D在周期表中位于第_______周期第________族,BD2的结构式为____________.
(3)五种元素原子半径由大到小的顺序是(用A~E字母表示)_______________。
(4)A、B、C、D可形成一种受热易分解的化合物,写出该化合物受热分解的化学方程式____________________________________________________________。
(5)E2D2化合物的电子式为_____________,该化合物中化学键类型有_______________.
(6)用电子式表示A2D的形成过 程_________________________________;
程_________________________________;
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):____,理由是______________。
(2)Y是____________________,Z是____________________,W是____________________。
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式__________。
A、B、C、D、E五种元素为1~18号元素。已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30。它们两两形成的化合物有甲、乙、丙、丁四种。这四种化合物中原子个数比如下表:
| 甲 |
乙 |
丙 |
丁 |
|
| 化合物中各元素原子个数比 |
A和C 1∶1 |
B和A 1∶2 |
D和E 1∶3 |
B和E 1∶4 |
(1)写出元素符号:A__________,B__________,C__________,D__________,E__________。
(2)向甲的水溶液中加入MnO2,氧化产物是____________________。
(3)已知有机物乙的分子为平面结构,键角都为120°,实验室制取乙的化学方程式为____________________。
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式是____________________。
(5)写出E原子的电子排布式____________________。
在A、B、C、D四种元素中,A为地壳中含量最多的元素;B的单质在所有气体中密度最小;C元素的原子失去两个电子后,其电子层结构和氩原子相同;D元素的原子核外有三个能层,各能层电子数之比为1∶4∶1。
(1)写出上述四种元素的名称:A__________,B__________,C__________,D__________。
(2)写出C2+的电子排布式__________。
(3)指出A、B、C三种元素所形成化合物中包含化学键类型____________________。
(4)分别用电子式表示:A与B形成化合物B2A、A与C形成化合物CA的过程。
一般较强酸可制取较弱酸, 这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH: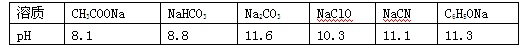
(1) 请根据上述信息判断下列反应不能发生的是________(填编号)。
| A.CH3COOH+NaCN===CH3COONa+HCN |
| B.CO2+H2O+2NaClO===Na2CO3+2HClO |
| C.2HCN+Na2CO3―→2NaCN+CO2+H2O |
| D.Na2CO3+C6H5OH―→NaHCO3+C6H5ONa |
E.CO2+H2O+C6H5ONa―→NaHCO3+C6H5OH
(2)己知常温时Ksp(AgCl)=1.8×10-10 mol2.L-2,向50 mL 0.018 mo1.L-l的AgNO3溶液中加入相同体积0.020 mol.L-1的盐酸,则c(Ag+)=。
物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 2(t-BuNO) 。
2(t-BuNO) 。
(1)当(t-BuNO)2的起始浓度(c0)为0.50 mol·L-1时,实验测得20℃时的平衡转化率(α)是65 %。列式计算20℃时上述反应的平衡常数K =。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。
(3)实验测得该反应的ΔH =" +" 50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。下列能量关系图合理的是。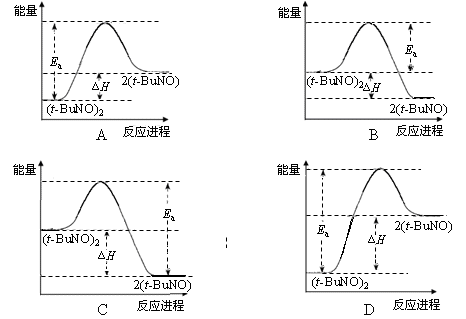
(4)结合ΔS推测该反应的在(填“较高”或“较低”)温度下有利于该反应自发进行。