已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a; X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: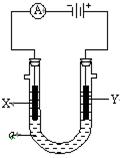
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为。在X极附近观察到的现象是。
② Y电极上的电极反应式为,
检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是,电极反应式是。
② Y电极的材料是,电极反应式是。
(说明:杂质发生的电极反应不必写出)
(4分)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是。
| A.配制标准溶液的氢氧化钠中混有Na2CO3杂质 |
| B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
E. 未用标准液润洗碱式滴定管
(8分)有两只密闭的容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的两容器中通入体积比为2:l的等量的S02和02,使之发生反应: 2S02 +02 2S03,并达到平衡。则(填<、=、>;左、右;增大、减小、不变)
2S03,并达到平衡。则(填<、=、>;左、右;增大、减小、不变)
(1)达到平衡所需的时间:tAtB,S02的转化率:aAaB。
(2)起始时两容器中的反应速率:vA_______vB,反应过程中的反应速率:vA______vB
(3)达到平衡时,向两容器中分别通入等量的氩气。A容器中的化学平衡向反应方向移动,B容器中的化学反应速率
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中的S02的百分含量,B容器中S02的百分含量。
(6分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ写出该反应的热化学反应方程式:。若1g水蒸气转化为液态水放热2.444kJ,则反应H2(g)+1/2O2(g)=H2O(g)的△H=kJ·mol-1。氢气的燃烧热为kJ·mol-1。
(6分)下列10种物质中:①NaOH溶液②H2SO4③硫酸铜晶体④Cu ⑤CH3COOH⑥NaOH固体⑦蔗糖⑧石灰水⑨水银⑩氨水
能导电的有;属于强电解质的有;属于弱电解质的有。