根据反应:Fe2O3+3CO 2Fe+3CO2,若有3 mol e-转移,则有_______mol 铁生成,有_______个CO分子参加反应。
2Fe+3CO2,若有3 mol e-转移,则有_______mol 铁生成,有_______个CO分子参加反应。
(1)已知:25℃时,Ksp[Mg(OH)2]=4×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
| pH |
<8.0 |
8.0~9.6 |
>9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
①25℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为 。
②25℃时,向该Mg(OH)2饱和溶液中加入适量稀盐酸达平衡后该溶液中c(OH-) , c(Mg2+)(填“增大”“减小”或“不变”) 。
(2)向50 mL 0.018 mol/L的AgNO3溶液中加入50 mL 0.020 mol/L的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①充分反应后,溶液中c(Ag+)= mol/L。
②充分反应后,溶液的pH= 。
(3)如图,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数,回答下列问题。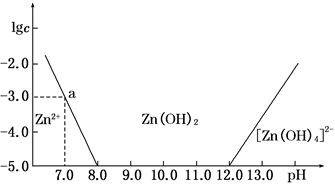
①往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为__________。
②从图中数据计算可得Zn(OH)2的溶度积Ksp=________。
③某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是___________________。
电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
| 化学式 |
电离平衡常数 |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得C(Na+)>C(CN-),下列关系正确的是。
A.C(H+)>C(OH-) B.C(H+)<C(OH-)
C.C(H+)+C(HCN) = C(OH-) D.C(HCN)+ C(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理________________________________。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________;质子守恒表达式 ___________________。
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO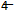 +H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
+H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
氮元素能形成多种多样的化合物。
(1)己知N2O4 (g) 2NO2 (g) ΔH=+57.20 kJ/mol ,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2 (g) ΔH=+57.20 kJ/mol ,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
| c(X)/(mol/L) |
0.2 |
c |
0.6 |
0.6 |
1.0 |
c1 |
c1 |
| c(Y)/(mol/L) |
0.6 |
c |
0.4 |
0.4 |
0.4 |
c2 |
c2 |
①c(X)代表 (填化学式)的浓度,该反应的平衡常数K= 。
②20 min时改变的条件是 ;重新达到平衡时,N2O4的转化率将 (填选项前字母)。
a.增大 b.减小 c.不变 d.无法判断
③t℃时,下列情况不能说明该反应处于平衡状态的是 ;
A.混合气体的密度保持不变 B.混合气体的颜色不再变化
C.混合气体的气体压强保持不变 D.N2O4与NO2的物质的量比为10:3
④若反应在t℃进行,某时刻测得n(NO2)="0.6" mol、n(N2O4)=1.2mol,则此时v(正) v(逆)(填 “>”、“<”或“=”)。
(2)已知2N2H4(l)+N2O4(l)="3N2(g)+4H2O(l)" ΔH=" -1225" kJ/mol
| 化学键 |
N-H |
N-N |
N≡N |
O-H |
| 键能(kJ/mol) |
390 |
190 |
946 |
460 |
则使1 mol N2O4 (l)完全分解成相应的原子时需要吸收的能量是。
短周期元素A、B、C、D在周期表中的位置如图所示:B、D最外层电子数之和为12。回答下列问题:
(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生成1 mol气态氢化物对应的热量变化如下,其中能表示该主族第4周期元素的单质生成1 mol气态氢化物所对应的热量变化是_______(选填字母编号)。
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8 kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2。
①查得:
| 化学键 |
H-H |
Br-Br |
H-Br |
| 键能(kJ/mol) |
436 |
194 |
362 |
试写出通常条件下电解槽中发生总反应的热化学方程式: 。
②根据资料:
| 化学式 |
Ag2SO4 |
AgBr |
| 溶解度(g) |
0.796 |
8.4×10-6 |
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到 ,证明分离效果较好。
③在原电池中,负极发生的反应式为 。
④在电解过程中,电解槽阴极附近溶液pH (填“变大”、“变小”或“不变”)。
⑤将该工艺流程用总反应的化学方程式表示为: 。该生产工艺的优点有 (答一点即可)。
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入________,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为________________ 。
目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2: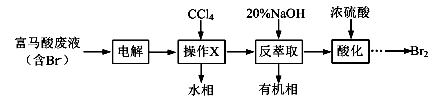
(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 。
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是: 。
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出。与传统工艺相比,萃取法的优点是 。
(4)已知在酸性条件下溴酸盐可发生如下离子反应:
Ⅰ.2BrO+10Cl-+12H+===5Cl2↑+Br2+6H2O;Ⅱ.6BrO+5Cl-+6H+===5ClO+3Br2+3H2O,现将120 mL 0.4 mol·L-1KBrO3溶液和100 mL 0.6 mol·L-1KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为________。