(10分)甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO(g)+ 2H2(g) CH3OH (g)
CH3OH (g)
(1)下图表示反应中能量的变化。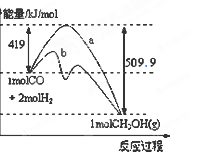
①此反应的ΔH=___________。
②已知CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3kJ·mol-1,试写出由CO2和H2制取甲醇的热化学方程式 。
CO(g)+H2O(g) △H=" +" 41.3kJ·mol-1,试写出由CO2和H2制取甲醇的热化学方程式 。
(2)一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入CH3OH和O2。装置图如下所示: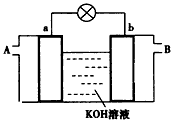
①经测定,电子流动方向由b到a,则甲醇从_______(填“A”或“B”)口通入,该极的电极反应式为___________________。
②该电池工作一段时间后,正极附近的碱性____(填“增强”、“减弱”或“不变”)。
③用该电池电解(惰性电极)硝酸银溶液时,每消耗32 g CH3OH,生成银的质量为___ g。
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s)  2Ca2++2K++Mg2++4
2Ca2++2K++Mg2++4 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,
①________________________________________________________,
②________________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+
 CaCO3(s)+
CaCO3(s)+
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
环境中常见的重金属污染物有:汞.铅.锰.铬.镉。处理工业废水中含有的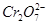 和
和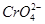 ,常用的方法有两种。
,常用的方法有两种。
方法1 还原沉淀法该法的工艺流程为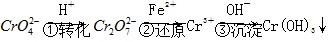 。
。
其中第①步存在平衡2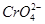 (黄色)+2H+
(黄色)+2H+
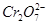 (橙色)+H2O。
(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol 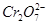 ,需要________mol的FeSO4·7H2O。
,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
方法2 电解法
(5)实验室利用如图装置模拟电解法处理含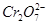 的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。
的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。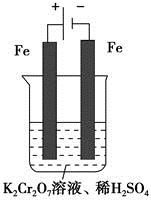
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题: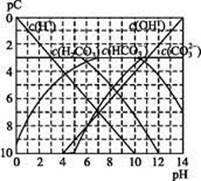
(1)在人体血液中,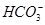 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
②正常人体血液中,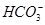 的水解程度 电离程度(填“<”“>”或“=”)。
的水解程度 电离程度(填“<”“>”或“=”)。
③pH=7.00的血液中,c(H2CO3) c(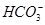 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
(2)H2CO3一级电离平衡常数的数值 ≈ 。
≈ 。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的C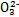 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)="0.15" mol·L-1.c(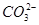 )="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。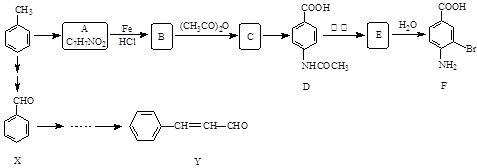
已知: 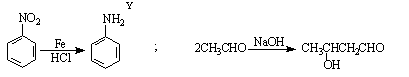
请回答下列问题:
(1)下列说法正确的是。
| A.F的分子式是C7H7NO2Br |
| B.甲苯的一氯取代物有3种 |
| C.F能发生取代反应和缩聚反应 |
| D.1mol 的D最多可以和5 mol H2发生加成反应 |
(2)D→E的反应类型是。
(3)B→C的化学方程式是。在合成F的过程中,B→C步骤不能省略,理由是。
(4)C→D反应所需的试剂是。
(5)写出同时符合下列条件的A的同分异构体的结构简式(写出3个)。
①苯环上只有两种不同化学环境的氢原子②分子中含有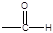
(6)以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图: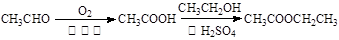
分子筛具有吸附能力强,热稳定性高等优良性能,使得分子筛获得广泛应用,某种型号分子筛的工业生产流程可表示如下:
在滴加氨水调节pH=9的过程中,若pH控制不当,会有Al(OH)3生成,假设生产过程中铝元素、硅元素均没有损失,钠原子利用率为10%。
(1)分子筛的直径为4A(1A=10-10m)称为4A型分子筛,当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得6A型分子筛。要高效分离正丁烷(分子直径为4.65A)和异丁烷(分子直径为5.6A)应该选用_______型分子筛。
(2)Al2(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为________________________
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要还有等离子。检验其中金属阳离子的操作方法是;
(4)加NH3•H2O调节pH后,加热到90℃并趁热过滤的原因可能是。
(5)该生产流程中所得分子筛的化学式为。(用氧化物形式表示)