污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等。


(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+ O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
C(s)+H2O(g) = CO(g) +H2(g) ΔH= 。
该反应的平衡常数表达式为K= 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (选填序号)。
a.CaCl2 b.氨水 c.Na2CO3 d.NaHSO3
(2)为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,
经过相同时间测得CO2气体浓度,其关系如图,则:
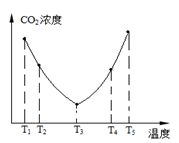
①T2、T4温度下,该反应的反应速率v2 v4(填“>”、“=”或“<”)。
②在T3~T4这个温度区间,容器内CO2气体浓度变化趋势的原因是: 。
(3)催化反硝化法降解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,用H2将NO还原为N2,一段时间后,
溶液的碱性明显增强。则反应离子方程式为: 。
②Murphy等人利用粉末铝去除废水总硝酸盐,反应主要产物为氨,占60~95%,可以通过气提法除去。反应方程式为:
3NO3- + 2Al + 3H2O → 3NO2- + 2Al(OH)3
NO2- + 2Al + 5H2O → NH3 + 2Al(OH)3 + OH-
2NO2- + 2Al + 4H2O → N2 + 2Al(OH)3 + 2OH-
若足量的铝与硝酸盐反应产生224mL(标准状况)混合气体,其中氨占80%,则被NO3-氧化的铝的物质的量为 。
下表列出了前20号元素中的某些元素性质的有关数据:
试回答下列问题: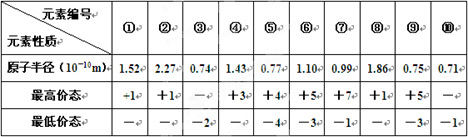
根据元素的主要化合价和原子半径可知,①~⑩分别是Cl、K、O、Al、C、P、Na、N、F。
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是(填写编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式。
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为。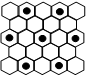
C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮。继C60后,科学家又合成了Si60、N60等球形分子。
(1)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为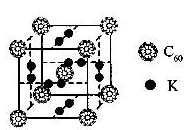
(2)Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为
(3)写试出C60、Si60、N60熔点由高到低的顺序为,破坏这三种分子所需要的能量顺序为
金属镁有许多重要的用途,法国化学家维多克·格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如下图: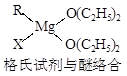
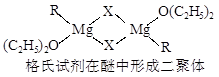
①标出格氏试剂中的配位键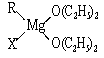
②下列比较中正确的是
A.金属键的强弱:Mg>Al B.基态原子第一电离能:Mg>Al
C.金属性:Mg>Al D.晶格能:KCl>NaCl
E.电负性:Mg>Al F.硬度:Mg>Al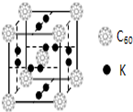
③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是。
A.苯与B3N3H6互为等电子体
www.kB.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
三种常见元素结构信息如下表,试根据信息回答有关问题:
| 元素 |
A |
B |
C |
| 结构信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 |
基态原子的M层有1对成对的p电子 |
基态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价 |
(1)写出B原子的基态电子排布式;(1分)
(2)用氢键表示式写出A的氢化物溶液中存在的所有氢键;A的氢化物分子结合一个H+形成阳离子后,其键角(填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为,
(4) 科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图可简单表示如下: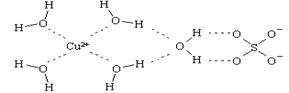
则胆矾晶体中含有
A.配位键 B.离子键 C.极性共价键 D. 金属键 E.氢键 F.非极性共价键
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。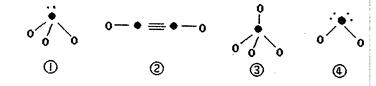
在以上分子中,中心原子采用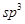 杂化形成化学键是(填写序号)。
杂化形成化学键是(填写序号)。
根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的外围电子排布式为:。
(2)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的
外围电子排布是4s24p4,该元素的名称是。
(3)根据VSEPR模型,H3O+的分子立体结构为:。
(4)含有非极性键的离子化合物(任写一种)。
(5)含有极性键和非极性键的极性分子(任写一种)。
(6)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成红色.该反应在有的教材中用方程式FeCl3+3KSCN===Fe(SCN)3+3KCl表示,经研究表明Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3的个数比配合,还可以其他个数比配合.若Fe3+与SCN-以个数比1∶1配合所得离子显红色.含该离子的配合物的化学式是.