卤块的主要成分是MgCl2,此外还含 Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图: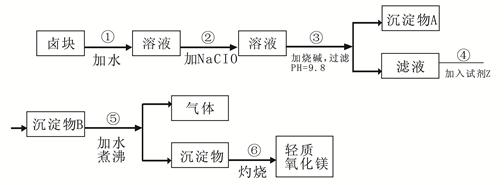
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH)2 |
9.6 |
11.1 |
表2 化学试剂价格表
| 试剂 |
价格(元/吨) |
| 漂液(含NaClO,25.2%) |
450 |
| 双氧水(含H2O2 ,30%) |
2400 |
| 烧碱(含98% NaOH) |
2100 |
| 纯碱(含99.5% Na2CO3) |
600 |
(1)在步骤②中加入漂液而不是双氧水其原因是 。
写出加入NaClO发生反应的离子方程式 。
(2)在步骤③中控制pH=9.8,其目的是 。
(3)沉淀物A的成分为 ,试剂Z应该是 。
(4)在步骤⑤中发生反应的化学方程式是 。
(5)若在实验室中完成步骤⑥,则沉淀物必需在 (填仪器名称)中灼烧。
(每空2分,共12分) 根据下面的反应路线及所给信息填空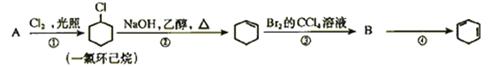
(1)A的结构简式是B的结构简式是
(2)①的反应类型是。③的反应类型是。
④的反应类型是
(3)反应④的化学方程式是。
23.(每空2分,14分)具有水果香味的中性物质A可以发生下列变化: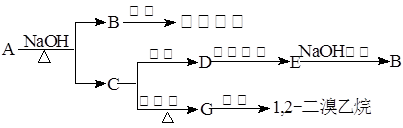
(1) 推断下述物质的结构简式:
A:________________ B:________________
C:________________ D:________________
(2) 写出下列变化的化学方程式:
A+NaOH→B+C:_____________________________________________
C→G:_________________________________________________
D→E:_________________________________________________
(每空2分,共12分)有一瓶澄清溶液,其中可能含NH4+、K+、Mg2+、Ba2+、Al3+、SO42-、CO32-中的一种或几种,取该溶液进行如下实验。
①取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中,溶液中先产生白色沉淀后沉淀部分溶解;
②将步骤①得到的碱性溶液加热,用湿润的红色石蕊试纸检验,试纸不变蓝。
③另取少量原溶液,加BaCl2溶液,有白色沉淀生成,加入盐酸,沉淀不溶解。
根据上述实验事实确定并回答:
(1)上述溶液中肯定存在的离子有,不能确定是否存在的离子有,为确认是否含有该离子,应做实验。
(2)写出步骤①中发生反应的离子方程式、、。
(每空2分,共12分)实验室欲配制220mL 0.2 mol·L-1的碳酸钠溶液,回答下列问题:
可供选择的仪器:①量筒②胶头滴管③托盘天平④药匙⑤烧瓶⑥烧杯
(1)通过计算可知,应用托盘天平称取g碳酸钠晶体(Na2CO3•10H2O)
(2)配制过程需要的仪器______________(填序号),还缺少的仪器有
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)_____________;
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.用托盘天平准确称取所需的Na2CO3固体的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将已冷却的溶液沿玻璃棒注入250mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作_____________;若定容时俯视刻度线______________。
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛的应用。请回答下列问题:
(1)氨气可由N2和H2反应制取,N2(g)+3H2(g) 2NH3(g)反应过程的能量变化如图所示:
2NH3(g)反应过程的能量变化如图所示:
已知:1molN2分子中的化学键断裂时需要吸收942kJ的能量;1molH2分子中的化学键断裂时需要吸收436kJ的能量;形成1mol N—H键时释放390.8kJ的能量。
①图中A、C分别表示、,E的大小对该反应的反应热有无影响?。
该反应需要用铁触媒作催化剂,加铁触媒会使图中B点升高还是降低?理由。
②图中△H=kJ·mol-1。
③如果反应速率ν(H2)为0.15mol· L-1·min-1,则ν(N2)=mol· L-1·min-1 ν(NH3)=
mol·L-1·min-1。
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l)△H= -19.5kJ·mol-1
N2H4(l)+O2(g)= N2(g)+2H2O(g)△H= -534.2kJ·mol-1
请写出肼和 N2O4反应的热化学反应方程式。