硫及其化合物和氮及其化合物在化学工业、环境保护中应用非常广泛。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致酸雨的形成,收集SO2形成的酸雨,pH逐渐减小,一定时间后pH不再变化,写出酸雨中反应的离子方程式 。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。己知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3l kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-112.97 kJ·mol-1
写出CH4(g)催化还原NO(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式: 。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,已知2SO2(g)+O2(g) 2SO3(g),△H=" —196" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,该温度下此反应的平衡常数K= ,用SO2表示的反应速率为 。
2SO3(g),△H=" —196" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,该温度下此反应的平衡常数K= ,用SO2表示的反应速率为 。
②一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1molO2,发生下列反应:2SO2(g)+O2(g) 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
| A.保持温度和容器内压强不变,充入1mol Ar |
| B.保持温度和容器体积不变,充入2 mol N2 |
| C.保持温度和容器体积不变,充入2 mol SO3 |
| D.升高温度 |
E.移动活塞压缩气体
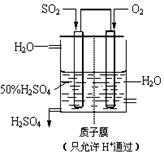
(4)某人设想以右图所示装置,用电化学原理生产硫酸,通入O2的电极为 极,写出通入SO2的电极的电极反应式 。
掺杂微量铜、硼、镓、硒等元素的单晶硅太阳能电池是第三代太阳能电池之一。
(1)Cu2+的电子排布式为___________________。
(2)已知铜转化为水合离子过程如下:
已知I1=745.5kJ/mol,I2=1957.3kJ/mol。在水溶液中Cu2+比Cu更稳定的原因是_____________。
(3)铜与类卤素(SCN)2反应生成Cu(SCN)2。1mol(SCN)2含有π键的数目为_______________。HSCN有两种结构,H-S-C≡N(硫氰酸)的沸点低于H-N=C=S(异硫氰酸)的沸点,其原因是_________________。
(4)BF3能与NH3反应生成配合物BF3-NH3,该配合物中B原子的杂化方式为___________________。
(5)铜和硒可形成的半导体团簇分子的球棍模型如图所示,其分子式为__________________。
(6)镓与某有机物形成的配合物过程如下图,在图上画出产物中的配位键。
(7)与Si同周期部分元素的电离能如下图所示,其中a、b和c分别代表_____________。
| A.a为I1、b为I2、c为I3 | B.a为I2、b为I3、c为I1 |
| C.a为I3、b为I2、c为I1 | D.a为I1、b为I3、c为I2 |
Ⅰ.由苯乙烯制得的聚苯乙烯可用于制造一次性餐具。
(1)苯乙烯的分子式为_______________。
(2)苯乙烯制取聚苯乙烯的化学方程式为______________________。
Ⅱ.聚苯乙烯塑料性质稳定,会造成严重的“白色污染”。为此人们开发出一种聚乳酸塑料来替代聚苯乙烯。聚乳酸合成过程如下:
(3)淀粉和纤维素的分子式均可表示为(C6H10O5)n,下列关于淀粉和纤维素的说法正确的是( )
| A.互为同分异构体 | B.水解最终产物相同 |
| C.纤维素是纯净物 | D.均是高分子化合物 |
(4)乳酸分子中所含官能团有_________________(填名称)。
(5)根据结构推断聚乳酸可能发生的反应类型是______________,并据此说明用聚乳酸塑料替代聚苯乙烯塑料的好处是_____________。
(6)乳酸与足量Na反应的化学方程式为____________________。
氮元素可形成丰富多彩的物质。
(1)基态氮原子的价电子轨道表示式为______________;等物质的量的NH3和N2混合气体中σ键与π键的数目之比为___________________。
(2)光化学烟雾易在PM2.5尘粒的催化作用下形成,光化学烟雾中含有NOx、O3、CH2=CHCHO、HCOOH等二次污染物。下列说法正确的是__________________。
| A.N2O与CO2互为等电子体,其结构式为N=N=O |
| B.O3的沸点大于O2 |
| C.CH2=CHCHO分子中碳原子的杂化方式为sp2、sp3 |
| D.HCOOH在水中溶解度大的原因与氢键有关 |
(3)在配合物中,下列微粒NH3、NH4+、NH2OH不能作为配位体的有____________。
(4)图a为六方氮化硼晶体结构示意图,该晶体中存在的作用力有______________。

(5)六方氮化硼在高温高压下可转化为立方氮化硼,其晶胞结构如图b,晶胞边长为dcm,该晶胞中含有_________个氮原子、__________个硼原子,立方氮化硼的密度是__________g·cm-3(阿伏伽德罗常数的值为NA)
海水提镁的工业流程如下
(1)煅烧贝壳时,贝壳的主要成分发生了什么变化?__________(用化学方程式表示)。
(2)从海水中的镁离子到金属镁,主要经历了三步化学变化,写出前两步反应的化学反应方程式:
①______________;②_______________。
③第三步反应(MgCl2 Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
(3)在生产过程中采用了一些措施提高经济效益,请写出一点____________________。
(4)输送氯气的管道需要定期检查是否漏气,管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=N2+6HCl。下列说法中正确的是__________。
A.用该方法检验管道泄漏处会产生白烟
B.管道泄漏处会闻到刺激性气味
C.该反应中的HCl是氧化产物,N2是还原产物
盛放NaOH溶液的试剂瓶不能用玻璃塞,是为了防止发生反应(用离子方程式表示)________,避免瓶口与瓶塞粘在一起。