碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s),则下列说法错误的是
A.电池工作时,锌 失去电子 失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-==Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g |
下列气体通入蒸馏水中,可生成两种酸的是
| A.Cl2 | B.CO2 | C.SO2 | D.NH3 |
下列有关化学用语表示正确的是
A.中子数为8的N原子: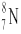 |
B.离子结构示意图:  只能表示 只能表示 |
| C.碳酸氢钠在水溶液中的电离方程式:NaHCO3=Na++HCO3- |
D.作为相对原子质量标准的碳原子: |
化学与环境密切相关,下列说法正确的是
| A.CO2属于大气污染物 |
| B.酸雨是pH小于7的雨水 |
| C.CO2、NO2或SO2都会导致酸雨的形成 |
| D.大雾是一种胶体,能发生丁达尔效应 |
取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为()。
| A.1:1 | B.2:3 | C.3:2 | D.1:6 |
下列反应的离子方程式书写正确的是 ()
| A.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| B.稀 H2SO4与铁粉反应: 2Fe+6H+=2Fe3++3H2↑ |
| C.氢氧化钡溶液与稀 H2SO4反应:Ba2++SO42-=BaSO4↓ |
| D.氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |