下列化合物中,既显酸性,又能发生加成反应、氧化反应、 酯化反应和消去反应的是
酯化反应和消去反应的是
A.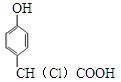 |
B.CH2(CHO)-CH2-CH(OH)-COOH |
C.CH3—CH="CH—COOH" | D.CH3CH(OH)CH2CHO |
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)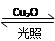 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.001 0 |
0.001 6 |
0.002 0 |
0.002 0 |
下列说法不正确的是 ( )。
A.前20 min内的平均反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表:
| 容器 编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是 ( )。
A.放出热量关系:a<b<92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g),ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g),ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是 ( )。
A.反应前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )。
CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )。
| A.增加压强 | B.降低温度 | C.增大CO的浓度 | D.更换催化剂 |
固体电解质通过其中的离子迁移进行电荷传递,因此又称为固体离子导体,RbAg4I5晶体就是一种重要的固体电解质,其中发生迁移的物质全是Ag+。利用RbAg4I5晶体,可以制成电化学气敏传感器,如图是一种测定O2含量的气体传感器示意图。被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势的变化可以得知O2的含量。在气体传感器的工作过程中,下列变化肯定没有发生的是 ( )。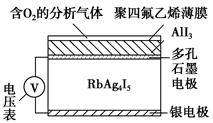
| A.I2+2Rb++2e-=2RbI |
| B.I2+2Ag++2e-=2AgI |
| C.Ag-e-=Ag+ |
| D.4AlI3+3O2=2Al2O3+6I2 |