1,2 - 二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃ ,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2- 二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2- 二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白: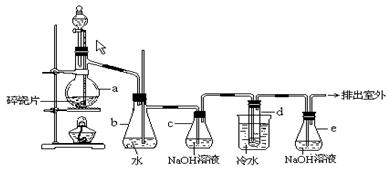
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式.
__________________ _______;____________________ __________ ______;
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象._______________________________________________________;
(3)容器c中NaOH溶液的作用是:__________________________________;
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫 酸混合液的量比正常情况下超过许多,如果装置的气密性没有问题,试分析其可能的原因:________ _______________________;_______________________ 。
酸混合液的量比正常情况下超过许多,如果装置的气密性没有问题,试分析其可能的原因:________ _______________________;_______________________ 。
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
(1)a极材料应为____________,电极反应式为____________________。
(2)电解液c可以是(填编号)__________。
| A.纯水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
(3)d为苯,其作用为_________________。在加入苯之前对c应做如何简单处理?___________________。
(4)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象是__________________________。
某工厂现用锗(Ge)产品加工废料生产纳米GeO2,实验流程如下图所示:
请回答下列问题:
(1)操作X的名称为_________。Y溶液是一种在该流程中可循环利用的物质,该物质是_________。
(2)请补充完整第②步反应的离子方程式: Ge2++
Ge2++ ________+
________+ H+===
H+=== Ge4++
Ge4++ ________。
________。
(3)若要将Fe(OH)3和Al(OH)3分离回收,需要用到的试剂有________(填化学式)。
(4)该锗产品加工废料中锗元素的质量分数不小于______________。
TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,与氢气的相对分子质量之比为120。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。其主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。
(1)写出C中的化学反应方程式:_________________
(2)B 中试剂是 ,作用是________________________
(3)实验后称得A及以后的装置(均用A装置并假设每次吸收均是完全的)质量依次
增加3.60 g、14.08 g、0.14 g,则TMB的分子式为__________________________。
(4)除A外还需重复使用D装置,该装置内药品是 ,如果缺少该装置将引起 元素的计算值 (填“偏高”,“偏低”,“无影响”)
(5)该实验 (填“需要”、“不需要”)尾气处理,请写明理由____________
应用下列装置,在硬质破璃管中放入还原铁粉和石棉绒的混合物加热,并通过水蒸气,就可以完成“高温下Fe与水蒸气的反应实验”。
请完成该实验中的问题:
(1)写出该反应的化学方程式: ;该氧化还原反应的氧化剂是 。
(2)实验前必须对整套装置进行的操作是 。
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(4)检验溶液中是否含有三价铁离子用 溶液(写化学式),现象是 。
某NaCl样品中混有NaBr杂质,为了测定该NaCl样品的纯度,设计的实验过程如下图所示:
阅读上述实验过程,完成下列填空:
(1)下图装置是用来完成向溶液甲中通入过量Cl2的实验,在下面表格A、B、D下填写装置中所放的化学药品。
| A |
→ |
B |
→ |
C |
→ |
D |
| 溶液甲 |
(2)萃取所需要的主要玻璃仪器是_______________;
(3)溶液甲中通入Cl2的化学方程式为 ;
(4)原固体样品中氯化钠的质量分数为__________________。