某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将89.6L混合气体通入足量溴水,溴水质量增重56.0 g,通过计算回答:
(1)依据题意知混合气体的平均相对分子质量为 ,则烷烃一定为 。
(2)混合气体中两种气体的物质的量之比(请写出计算过程)
(3)写出混合气体中气态烯烃可能的结构简式:
已知石棉通常由钙、镁、硅、氧、氢等五种元素组成。实验测得某种石棉不含氢,且其钙、镁、硅的原子个数比为1∶3∶4,相对式量不超过500。
(1)用SiO2和金属氧化物的形式表示该种石棉的组成。
(2)该种石棉中含CaO、MgO和SiO2的质量分数。
CH3—CH3→CH2=CH2+H2;有关化学键的键能如下。
| 化学键 |
C-H |
C=C |
C-C |
H-H |
| 键能(kJ·mol—1) |
414.4 |
615.3 |
347.4 |
435.3 |
试计算该反应的反应热
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应: ;
银片上发生的电极反应: 。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA=6.02×1023/mol,电子电荷为1.60×10-19 C)
将一定质量的Mg、Al合金全部溶解在500 mL盐酸中(体积变化不计),取10 mL反应后的溶液,用1 mol/L NaOH溶液滴定得下图关系。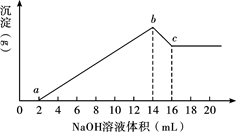
(1)求Mg、Al质量各是多少?
(2)求盐酸的物质的量浓度为多少?
将224 mL标准状况下甲烷和氧气的混合气体点燃,完全燃烧后,将生成的气体通入100 mL 0.02 mol·L-1的石灰水中,得到0.1 g 白色沉淀。求原混合气体中甲烷和氧气的体积比。