在反应2SO2(g)+O2(g) 2SO3(g)中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为
2SO3(g)中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为
下列实验和结论不正确的是
| A.明矾和漂白粉均可用于自来水的杀菌、消毒 |
| B.用丁达尔实验可以将Al(OH)3胶体和NaCl溶液区分 |
| C.向KI溶液滴加氯水和CCl4振荡,静置后分层且下层显紫色,则氧化性:Cl2>I2 |
| D.Al(OH)3与稀H2SO4、NaOH溶液均能反应,说明AI(OH)3是两性氢氧化物 |
下列无色溶液中,离子能大量共存的是
| A.Ca2+、H+、HCO3-、C1- | B.Ba2+、K+、OH一、NO3- |
| C.Cu2+、Na+、MnO4一、SO42一 | D.Fe3+、A13+、SCN一、HCO3— |
下列说法正确的是()
| A.淀粉在人体内能水解成葡萄糖 | B.纤维素和淀粉遇碘水均呈蓝色 |
| C.葡萄糖和淀粉均属于高分子化合物 | D.凡含有食品添加剂的食物均不可食用 |
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是
CH3OH(g)+H2O(g)ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是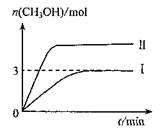
| A.曲线II对应的条件改变是增大压强 |
| B.T2°C时,上述反应平衡常数为0.42,则T2> T1 |
| C.在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆) |
D.在T10C,若起始时向容器由通入4,5 molCO2、6mol H2 ,平衡时容器内压强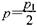 |
25°C时,c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液中,c(CH3COOH)、 c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是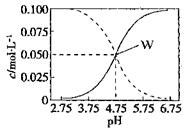
| A.pH=4的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| B.W点所表示的溶液中:c(Na+)+ c(H+)= c(CH3COOH)+c(OH-) |
| C.将W点所表示的1.0L溶液稀释到10L,用pH计测量,溶液的pH应为5.75 |
| D.pH=5.5的溶液中:c(Na+)+ c(H+)- c(OH-)+c(CH3COOH)=0.1mol/L |