(用数字序号填空,共 9分)有①NH2-CH2-COOH ②CH2OH(CHOH)4CHO ③(C6H10O5)n(纤维素) ④HCOOC2H5 ⑤苯酚 ⑥HCHO等物质, 其中:
9分)有①NH2-CH2-COOH ②CH2OH(CHOH)4CHO ③(C6H10O5)n(纤维素) ④HCOOC2H5 ⑤苯酚 ⑥HCHO等物质, 其中:
(1)难溶于水的是 ,易溶于水的是 ,常温下在水中溶解度不大,70℃时可与水任意比例互溶的是 。
(2)能发生银镜反应的是 。
(3)能发生酯化反应的是 。
(4)能跟氢气发生加成反应的是 ,能在一定条件下跟水反应的是 。
(5)能跟盐酸反应的是 ,能跟氢氧化钠溶液反应的是 。
【化学——选修5:有机化学基础】
已知:①一个碳原子上连有两个羟基时,易发生下列转化:(R、R′代表烃基或氢原子)。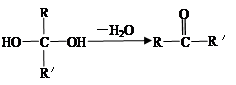
②同一个碳原子上连有两个双键的结构不稳定。根据下图回答有关问题: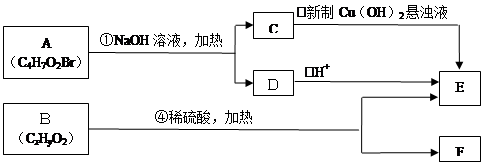
(1)E中含有的官能团的名称是;C与新制氢氧化铜反应的化学方程式为。
(2)A的结构简式为。A不能发生的反应有(填字母)。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
(3)已知B的相对分子质量为188,其充分燃烧的产物中n(CO2):n(H2O)=2∶1。则B的分子式为。
(4)F具有如下特点:①能与FeCl3溶液发生显色反应;②核磁共振氢谱中显示有五种吸收峰;③苯环上的一氯代物只有两种;④除苯环外,不含有其他环状结构。写出符合上述条件,具有稳定结构的F可能的结构简式:。
【化学——选修3:物质结构与性质】
Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2。
(1)与氮元素处于同一周期且相邻的两种元素分别是,这三种元素的第一电离能由大到小的顺序是,电负性由小到大的顺序是。
(2)与NH3互为等电子体的分子、离子有、(各举一例)。
(3)碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物,其毒副作用低于顺铂。碳铂的结构如图: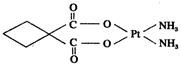
碳铂分子中含有的作用力有(填字母)。
| A.极性共价键 | B.非极性共价键 | C.配位键 | D.离子键 |
E.金属键 F. 键 G.
键 G.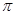 键
键
(4)碳铂中C原子的杂化方式有。
(5)铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。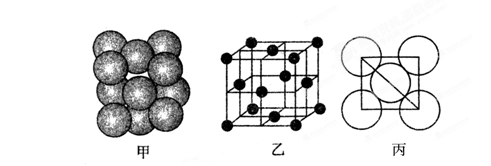
晶胞中铂(Pt)原子的配位数为。若已知铂(Pt)的摩尔质量为M g/mol,阿伏加德罗常数为NA,Pt原子半径为b pm,则该晶胞的密度为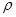 =g/cm3。(用含M、NA、b的计算式表示,不用化简)。
=g/cm3。(用含M、NA、b的计算式表示,不用化简)。
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子,B元素在周期表中的位置为,A2+在基态时外围电子(价电子)占据的能层符号为,外围电子(价电子)排布式。
甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡常数 |
温度℃ |
|
| 500 |
800 |
||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.15 |
②H2(g)+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) |
K2 |
1.0 |
2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) |
K3 |
(1)反应②是(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图所示。则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示)。
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。
(4)甲醇燃料电池有着广泛的用途,同时Al—AgO电池是应用广泛的鱼雷电 池,其原理如右图所示。该电池的负极反应式是。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为。
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下: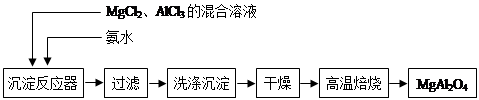
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式。
(2)如图所示,过滤操作中的一处错误是。判断流程中沉淀是否洗净所用的试剂是。高温焙烧时,用于盛放固体的仪器名称是。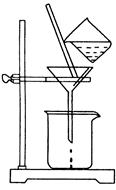
(3)在25℃下,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴 加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
装置B中盛放饱和NaCl溶液,该装置的主要作用是;F中试剂的作用是;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为。
(5)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2 mol/L的NaOH溶液80 mL时金属离子恰好完全沉淀。则形成沉淀的质量为g。
二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)①TiCl4水解生成TiO2·xH2O的化学方程式为。
②检验TiO2·xH2O中Cl-是否被除净的方法是。
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下: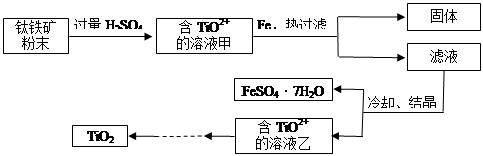
(2)Fe2O3与H2SO4反应的离子方程式是。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有。
(4)加Fe的作用是。
Ⅱ、二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
TiO2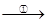 TiCl4
TiCl4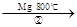 Ti
Ti
反应②的方程式是,该反应需要在Ar气氛中进
行,请解释原因:。