(15分)
合成氨对化学工业和国防工业具有重要意义。
(1) 向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为T0C时平衡混合物中氨气的体积分数与压强(P)的关系图。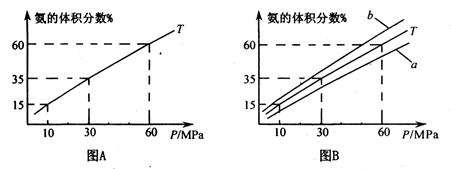
①写出工业上合成氨的化学方程式_____________________。
②图A中氨气的体积分数为15.00%时,H2的转化率="_______ " 。
③图B中T=5000C,温度为4500C对应的曲线是_______(选填字母“a"或“b ”),选择的理由是______________
④由图像知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是_______(写出一条即可)。
(2) 合成氨 所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
所需的氢气可由甲烷与水反应制得,反应的热化学方程式为: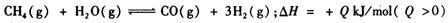
(3) 一定温度下,在2 L容器中发生上述反应,各 物质的物质的量变化如下表
物质的物质的量变化如下表
| 时间/min |
CH4(mol) |
H20( mol) |
CO (mol) |
H2 (mol) |
| 0 |
0.40 |
1.00 |
0 |
0 |
| 5 |
X1 |
X2 |
X3 |
0.60 |
| 7 |
Y1 |
Y2 |
0.20 |
Y3 |
| 10 |
0.21 |
0.81 |
0.19 |
0.62 |
①分析表中数据,判断5〜7min之间反应是否处于平衡状态____________(填“是”或“否”),
前5 min平均反应速率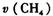 =______。
=______。
②反应在7~ 10 min之间,CO的物质的量减少的原因可能是______(填字母)。
a• 减少CH4 b•降低温度 c•增大压强 d•充入H 2
2
③若保持温度不变,向1L容器中起始充入0.15 mol CH4.0.45 mol H2O. ______mol CO、______mol H2 ,达到平衡时CH4的体积百分含量与第一次投料相同。
根据下图所示的物质之间的转化关系,其中A为单质,回答下列有关问题。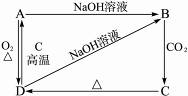
(1)写出A、B、C、D各物质的名称:
A,B,
C,D。
(2)写出下列变化的化学方程式:
D→A;
B→C;
D→B。
某型号的水泥主要成分有Ca2SiOx、Ca3SiOy、Ca3Al2Oz,则x=,y=,z=。
水泥具有水硬性,跟水掺和搅拌后很容易,水泥要保存。
普通水泥以和为主要原料,煅烧后再加入适量,用以调节硬化速度。
用高岭土(主要成分是Al2O3·2SiO2·2H2O,并含有少量CaO、Fe2O3)研制新型净水剂(铝的化合物)。其步骤如下:将土样和纯碱混合均匀,加热熔融,冷却后加盐酸分别得到沉淀和溶液,溶液即为净水剂。
(1)写出熔融时主要成分与纯碱反应的化学方程式(Al2O3与强碱反应相似)。
(2)最后的沉淀是,生成沉淀的离子方程式是。
(3)实验室中常用的有瓷坩埚、氧化铝坩埚和铁坩埚,本实验应选用坩埚。
“9·11”事件已过去多年,但其留给人们的伤害还存在。科学家曾警告说,随着美国世贸大厦的轰然倒下,原来在建筑大厦时用的大量石棉将释放出来污染环境(石棉有毒,能使人患肺癌)。石棉是一种具有压伸强度大、柔韧性强、耐热、耐火焰、耐酸碱腐蚀、价格低廉的硅酸盐。完成下列问题:
(1)有一种石棉叫矿青石棉,其分子式为Na2Fe5Si8O22(OH)2,其中铁的平均化合价为_______________,铁的氧化物的物质的量分数为____________(铁用氧化物的形式表示)。
(2)研究表明,在硅酸盐中,Al3+很容易取代Si4+,取代后不会引起原硅酸盐结构大的变化。从立体几何的知识看,Al3+与Si4+最直接的关系是__________________________________。
如下图,已知:①单质E可作为半导体材料;②化合物F是不成盐氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应。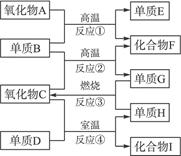
请完成下列问题:
(1)化合物F是___________________。
(2)化合物I是___________________。
(3)反应③的化学方程式是______________________________________________________。
(4)反应④的化学方程式是_____________________________________________________。