有下列四种微粒: ①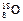 ,②
,②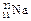 ,③
,③ ,④
,④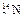 。(填序号)
。(填序号)
(1)微粒中质子数小于中子数的是____▲___。
(2)在化合物中呈现的化合价的数值最多的是__▲_。
(3)能形成X2Y2型化合物的是__▲____,电子式为 ▲ ;能形成X3Y2型化合物的是___▲____。
有A、B、C、D 4种烃,各取0.01 mol充分燃烧后,B、C、D所产生的二氧化碳均为448 mL(标准状况);A燃烧所得的二氧化碳是其他三者的3倍。在镍催化剂的作用下,A、B、C都能和氢气发生加成反应,B可以转变为C或D,C可以转变为D;B或C都能使酸性高锰酸钾溶液褪色,而A、D无此性质;在FeBr3存在时,A与液溴发生取代反应。
试推断出4种烃的结构简式:
(1)A是 ,B是 ,C是 ,D是 。
(2)B→D的反应方程式: 。
(3)除去D中C的反应方程式: 。
(4)C发生加聚反应的方程式: 。
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有 Ti和
Ti和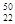 Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于 区元素
Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于 区元素
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是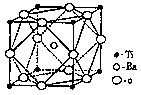
(3)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。
| A.苯与B3N3H6互为等电子体 |
| B.甲醛、苯分子中碳原子均采用sp2杂化 |
| C.苯、二氧化碳是非极性分子,水和甲醛是极性分子 |
| D.水的沸点比甲醛高得多,是因为水分子间能形成氢键 |
K4[Fe(CN)6]强热可发生反应:3 K4[Fe(CN)6]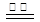 2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
(1)K4[Fe(CN)6]中Fe2+的配位数为 (填数字);Fe2+基态核外电子排布式为 。
(2)(CN)2分子中碳原子杂化轨道类型为 ;1mol(CN)2分子中含有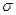 键的数目为 。
键的数目为 。
(3)O 与CN
与CN 互为等电子体,则O
互为等电子体,则O 的电子式为 。
的电子式为 。
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为 。
硫-氨热化学循环制氢示意图如下: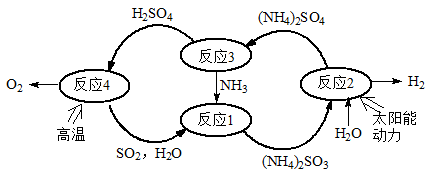
(1)反应1的离子方程式为 。
(2)反应2能量转化主要方式为 。
(3)反应3中控制反应条件很重要,不同条件下硫酸铵分解产物不同。若在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,B能使湿润的红色石蕊试纸变蓝,C能使品红溶液褪色。则400℃时硫酸铵分解的化学方程式为 。
(4)反应4是由(a)、(b)两步反应组成:
H2SO4(l) =SO3(g) +H2O(g),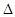 H=+177kJ•mol-1……(a)
H=+177kJ•mol-1……(a)
2SO3(g) 2SO2(g) + O2(g),
2SO2(g) + O2(g),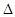 H="+196" kJ•mol-1……(b)
H="+196" kJ•mol-1……(b)
①则H2SO4(l)分解为SO2(g)、O2(g)及H2O(g)的热化学方程式为: 。
②在恒温密闭容器中,控制不同温度进行SO3分解实验。以SO3起始浓度均为cmol·L-1,测定SO3的转化率,结果如图,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率。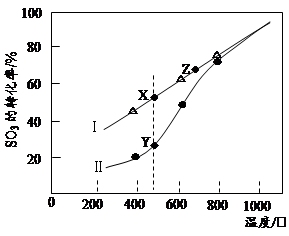
i)图中点X与点Z的平衡常数K:K(X) K(Z)(选填:>,<,=);
ii)Y点对应温度下的反应速率:v(正) v(逆)(选填:>,<,=);
iii)随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是: 。
PbI2是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成PbI2的实验流程如下:

(1)将铅块制成铅花的目的是 。
(2)31.05g铅花用5.00mol·L-1的硝酸溶解,至少需消耗5.00 mol·L-1硝酸 mL,同时产生 L(标准状况下)NO。
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中加热,测得样品固体残留率
随温度的变化如下图所示(已知:样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb·nH2O中结晶水数目n= (填数字)。
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为 (写结构简式)。
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL。计算室温时PbI2的Ksp (请给出计算过程)。