、能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
⑴工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) H1
H1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) H2
H2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”);
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断 H1 0(填“>”“=”或“<”);
H1 0(填“>”“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0 .2mol·L-1,则CO的转化率为 ,此时的温度
.2mol·L-1,则CO的转化率为 ,此时的温度
为 (从上表中选择)
⑵将CH4转化成CO,工业上常采用催化转化技术,其反应原理为: CH4(g)+3/2O2(g)
CH4(g)+3/2O2(g) CO(g)+2H2O(g)
CO(g)+2H2O(g) H=-519kJ·mo
H=-519kJ·mo l-1。工业上,为选择合适的催化剂,分别对X、Y、Z三种催化剂进行了如下实验(其他条件相同)
l-1。工业上,为选择合适的催化剂,分别对X、Y、Z三种催化剂进行了如下实验(其他条件相同)
①X在 T1℃时催化效率最高,能使正反应速率加快约3×105倍;
T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1> T2> T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”、“Y”或“Z”)选择的理由是 。
下图是CH2=CH—CH=CH2合成D(OHC—CH=CH—CHO)的流程。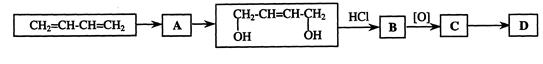
回答下列问题:
(1)若A为溴代物写出其结构简式 。
(2)写出B C反应的化学方程式 。
C反应的化学方程式 。
(3)写出C D的反应类型 。
D的反应类型 。
(4)已知CH2=CH—CH=CH2+CH2=CH2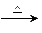
 ,请写出CH2=CH—CH=CH2两分子加成后的产物 。
,请写出CH2=CH—CH=CH2两分子加成后的产物 。
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为 。
(2)A与溴的四氯化碳溶液反应的化学方程式为 ,反应类型是 ;
(3)已知: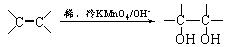 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应所得的产物 ;
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应所得的产物 ;
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式 ;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为 。
(Ⅰ)某化学兴趣小组从有机废液中(主要含甲苯、二甲苯、苯酚)提取苯酚的流程图如下:
请填写下列空白:
(1)A的化学式是 。
(2)振荡的目的是 。
(3)分液操作需要的玻璃仪器有 。
(4)写出水层中有关物质与A气体反应生成苯酚的化学方程式: 。
(Ⅱ)甲苯和溴乙烷混合物可通过如下流程进行分离。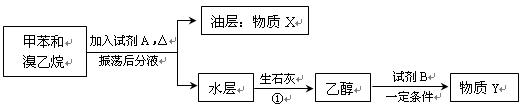
请填写下列空白:
(1)试剂A的名称为 。
(2)写出在甲苯与溴乙烷的混合物中加入试剂A时发生反应的化学方程式: 。
已知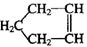 可简写为
可简写为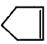
Ⅰ.降冰片烯的分子结构可表示为: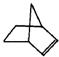
(1)降冰片烯属于__________。
a.环烷烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯不具有的性质__________。
a.能溶于水 b.能发生氧化反应
c.能发生加成反应 d.常温常压下为气体
Ⅱ.利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为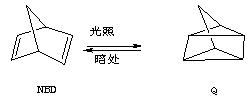
(1)NBD有多种同分异构体,其中属芳香烃的只有一种,其结构简式为,系统命名为。
(2)四环烷(Q)一氯代物共有种。
影响化反应速率的因素很多,某校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响化学反应速率的因素。
甲同学的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ②___________________ |
反应速率Fe>Mg,Cu反应 |
金属性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为_________________________;
(2)甲同学的实验目的是_________________________;要得出正确的实验结论,还需要控制实验的条件是_____________________________;
乙同学为了更精确地研究浓度对反应速率的影响,
利用右图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是_________________________;
(4)乙同学完成该实验应选用的实验药品是_________________________。