已知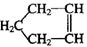 可简写为
可简写为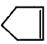
Ⅰ.降冰片烯的分子结构可表示为: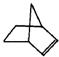
(1)降冰片烯属于__________。
a.环烷烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯不具有的性质__________。
a.能溶于水 b.能发生氧化反应
c.能发生加成反应 d.常温常压下为气体
Ⅱ.利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为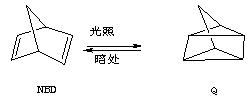
(1)NBD有多种同分异构体,其中属芳香烃的只有一种,其结构简式为 ,系统命名为 。
(2)四环烷(Q)一氯代物共有 种。
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。
请回答下列问题:
(1)Na3N是由_________键形成的化合物。
(2)Na3N与盐酸反应生成__________种盐。
(3)Na3N与水的反应属于______________反应
通常碘在水、酒精等溶剂中呈褐色,而在苯、四氯化碳等溶剂中呈紫色,试推测碘分别在二硫化碳和氯仿(CHCl3)中的可能颜色。在CS2中,在氯仿中。
A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电子数比K层多2个,而C原子核外的最外层电子数比次外层电子数少2个。它们的元素符号分别为:A;B;C;BC2是由键组成的(填“极性”或“非极性”)分子。
溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
(1)溴化碘的电子式是,它是由键形成的分子。
(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为。
硫化氢(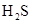 )分子中,两个H—S键的夹角接近90°,说明
)分子中,两个H—S键的夹角接近90°,说明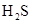 分子的空间构型为;二氧化碳(
分子的空间构型为;二氧化碳( )分子中,两个C=O键的夹角是180°,说明
)分子中,两个C=O键的夹角是180°,说明 分子的空间构型为;甲烷(
分子的空间构型为;甲烷(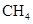 )分子中,两个相邻C—H键的夹角是109°28′,说明CH4分子的空间构型为。
)分子中,两个相邻C—H键的夹角是109°28′,说明CH4分子的空间构型为。
空格处是横线