用l-丁醇、溴化钠和过量较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物。现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。请根据实验步骤,回答下列问题:
⑴关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。竖直冷凝管的作用是,写出该反应的化学方程式。
⑵理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢、硫酸氢钠、水等。熄灭A处酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是、。
(3)相关有机物的数据如下:
为了进一步精制1-溴丁烷,继续进行了如下实验:待烧瓶冷却后,拔去竖直的冷凝管,塞上带温度计的橡皮塞,关闭a,打开b,接通冷凝管的冷凝水,使冷水从(填c或d)处流入,迅速升高温度至℃,收集所得馏分。
(4)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1-溴丁烷,则1-溴丁烷的产率是。
Ⅰ:在H2O2作用下可实现Fe(CN)63-与Fe(CN)64-之间的相互转化,在酸性溶液中H2O2可使Fe(CN)64-转化为Fe(CN)63-;在碱性溶液里H2O2可使Fe(CN)63-转化为Fe(CN)64-。写出以上相互转化的离子方程式。
①酸性溶液中:,
②碱性溶液中:。
Ⅱ:膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。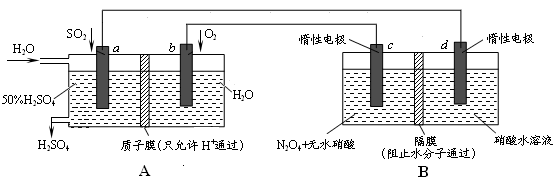
(3)A装置是________,B装置是_________(填“原电池”或“电解池”)。
(4)N2O5在装置中的______区(填“正、负极”或“阴、阳极”)生成,其电极反应式为______________。
(5)通入O2一极的电极反应式为_______________________________。
向一密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。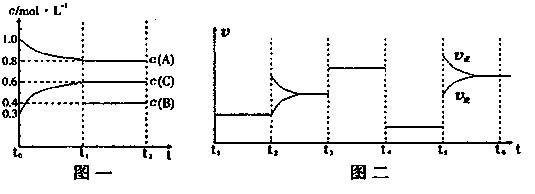
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=。
(2)t4-t5阶段改变的条件为,B的起始物质的量为。
该反应方程式可表示为
各阶段平衡时对应的平衡常数如下表所示:
| t1—t2 |
t2—t3 |
t3—t4 |
t4—t5 |
t5—t6 |
| K1 |
K2 |
K3 |
K4 |
K5 |
则K1=(保留两位小数),K1、K2、K3、K4、K5之间的关系为
K1K2K3K4K5(用“>”、“<”或“=”连接)
(3)在相同条件下,若起始时容器中加入a molA、bmolB和cmolC,要达到t1时刻同样的平衡(各物质的百分含量相同),a、b、c要满足的条件为。
(含a,b,c的代数式表示)
(1)同分异构体现象在有机化学中是非常普遍的,下列有机物互为同分异构体的是、
①CH2=CHCH3②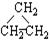 ③CH3CH2CH3④HC
③CH3CH2CH3④HC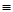 CCH3
CCH3
⑤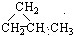 ⑥CH3CH=CHCH3
⑥CH3CH=CHCH3
写出⑥的其它链状同分异构体及名称。
(2)最近我国自主研制了一种新型燃料电池,一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了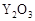 的
的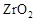 晶体,它在高温下能传导
晶体,它在高温下能传导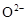 。回答如下问题:①以丁烷(
。回答如下问题:①以丁烷(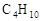 )代表汽油,这个电池放电时发生反应的化学方程式是_________________________________________________________。
)代表汽油,这个电池放电时发生反应的化学方程式是_________________________________________________________。
②这个电池的正极发生的反应是_________________,固体电解质里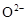 的移动方向是__________________ 。
的移动方向是__________________ 。
(3)下图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH2K2CO3+6H2O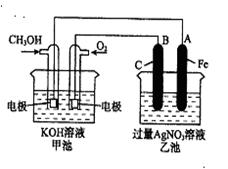
①请回答:甲池是装置,B(石墨)电极的名称是。
②写出下列电极反应式: 通入CH3OH 的电极的电极反应式是,
A(Fe)电极的电极反应式为。
③乙池中反应的化学方程式为。
④当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上转移电子mol。
化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质。 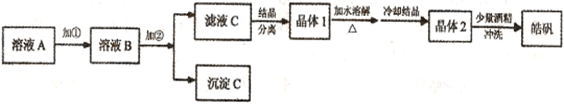 (l)制备皓矾的实验流程如下图所示。
(l)制备皓矾的实验流程如下图所示。
已知:下列氢氧化物开始生成沉淀到沉淀完全的pH范围分别为:
| 开始沉淀 |
沉淀完全 |
|
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Zn(OH)2 |
5.7 |
8.0 |
回答下列问题:
可供选择使用的有:氯水、20%的H2O2、氨水、NaOH溶液、Zn(OH)2、ZnO
① 加入的试剂①,应选用,作用:。
② 加入的试剂②调节pH,可选用或,用离子方程式表示其原理
。
③有同学提出,应将晶体1加入稀硫酸中溶解,原因是。
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是。
(2)检验皓矾中是否含有Fe元素的操作(试剂自选)。